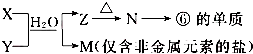题目内容
17.经X射线研究证明:PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成.下列关于PCl5的推断正确的是( )| A. | PCl5固体是分子晶体 | |
| B. | PCl5固体有良好的导电性 | |
| C. | PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1:1 | |
| D. | PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1:1 |
分析 PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,在杂化轨道理论中,正四面体构型的粒子只有AB4型,正八面体只有AB6型,结合该固体状态化学式知,PCl5晶体由[PCl4]+和[PCl6]-构成,据此分析解答.
解答 解:A.PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,所以其构成微粒是阴阳离子,为离子晶体,故A错误;
B.离子晶体在熔融状态下能导电,在固体时没有自由移动离子而不能导电,故B错误;
C.在杂化轨道理论中,正四面体构型的粒子只有AB4型,正八面体只有AB6型,结合该固体状态化学式知,PCl5晶体由[PCl4]+和[PCl6]-构成,在离子化合物中,阴阳离子所带电荷相等,所以阴阳离子数目之比为1:1,故C正确;
D.根据C知,PCl5晶体由[PCl4]+和[PCl6]-构成,故D错误;
故选C.
点评 本题考查物质结构性质,侧重考查学生获取信息利用信息解答问题能力,熟悉常见微粒空间构型及该物质中微粒的正确判断是解本题关键,易错选项是C.

练习册系列答案
相关题目
7.下列物质中含有共价键的离子化合物是( )
| A. | Ba(OH)2 | B. | H2O | C. | O2 | D. | CaCl2 |
8.下列说法中不正确的是( )
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯(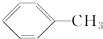 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |
9.(1)Ⅰ.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIA族.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
6.100mL浓度为2mol•L-1的硫酸跟过量的锌片反应,某同学想加快反应速率,又不影响成氢气的总量,下列操作不符合要求的是( )
| A. | 将锌片换成等量的锌粉 | B. | 加入数滴氯化铜溶液 | ||
| C. | 升高温度 | D. | 加入适量的6mol•L-1的硫酸 |
9.下列装置或操作能达到实验目的是( )
| A. | 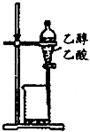 除去乙醇中的乙酸 | B. | 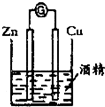 形成原电池 | ||
| C. |  制取乙酸乙酯 制取乙酸乙酯 | D. | 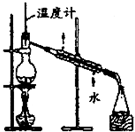 石油的分馏 |
 、
、 .
.
 或
或 .
.