题目内容
14.在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )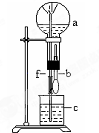
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | NaHCO3溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,说明a可溶于b或与b反应,导致烧瓶压强减小,以此解答该题.
解答 解;A.NO2与水反应,生成硝酸和NO,容器内气体减少,气压减小,形成喷泉,但由于NO不溶于水,所以不充满烧瓶.故A错误;
B.二氧化碳不溶于饱和碳酸氢钠溶液,不能充满烧瓶,故B错误;
C.Cl2不溶于饱和氯化钠溶液,也不与其反应,锥形瓶与烧瓶内压强相等,不能形成喷泉,故C错误;
D.氨气易溶于水,和盐酸发生反应,气体被吸收进溶液中,烧瓶内压强减小为零,同外界大气压产生压强差,所以形成喷泉,并充满烧瓶,故D正确;
故选D.
点评 本题考查喷泉实验,为高频考点,侧重于学生的分析能力的考查,注意反应物或生成物的状态变化会引起气压的变化,把握化学和物理的联系,知道解决化学问题可以应用物理知识,题目难度不大.

练习册系列答案
相关题目
4.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 |
9.(1)Ⅰ.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIA族.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的$\frac{2}{3}$.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的$\frac{2}{3}$.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
19.下列化学用语表达正确的是( )
| A. | 羟基的电子式: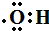 | B. | 聚丙烯结构简式: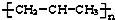 | ||
| C. | CO2的比例模型: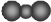 | D. | 乙烯的结构简式:CH2CH2 |
6.100mL浓度为2mol•L-1的硫酸跟过量的锌片反应,某同学想加快反应速率,又不影响成氢气的总量,下列操作不符合要求的是( )
| A. | 将锌片换成等量的锌粉 | B. | 加入数滴氯化铜溶液 | ||
| C. | 升高温度 | D. | 加入适量的6mol•L-1的硫酸 |
5.在恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是( )


| A. | 新旧平衡态时,A的体积分数相同 | |
| B. | 由旧平衡变为新平衡态,平衡常数不变 | |
| C. | 旧平衡态的v正与新平衡态的v逆相等 | |
| D. | t2时刻速率突变的原因是向密闭容器中加C或B |
6.宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记录,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O下列有关该反应的说法正确的是( )
| A. | Ag是氧化物 | B. | O2被氧化 | ||
| C. | H2S发生还原反应 | D. | H2S未发生电子转移 |
 、
、 .
.