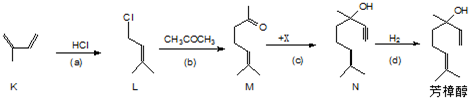
题目内容
9.常温下,在0.01mol/LNaOH溶液中,c(OH-)=0.01mol/L,c(H+)=10-12mol/L,由水电离出的c(H+)=10-12mol/L,由水电离出的c(OH-)=10-12mol/L.分析 NaOH是强电解质,在水溶液中完全电离,水电离出氢氧根离子,但浓度较小,所以溶液中c(NaOH)=c(OH-),溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,水电离出的c(OH-)=c(H+),据此分析解答.
解答 解:NaOH是强电解质,在水溶液中完全电离,水电离出氢氧根离子,但浓度较小,所以溶液中c(NaOH)=c(OH-)=0.01mol/L,溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,碱性溶液中氢离子完全是水电离出的,所以水电离出的c(OH-)=c(H+)=10-12mol/L,
故答案为:0.01mol/L;10-12mol/L;10-12mol/L;10-12mol/L.
点评 本题以水的电离、氢氧化钠的电离为载体考查物质的量浓度的计算,侧重考查学生分析计算能力,难点是计算碱溶液中水电离出c(OH-),注意溶液中c(OH-)与水电离出c(OH-)的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 | |
| C. | 工业冶炼铝时电解Al2O3并加入冰晶石(Na3AlF6),是为了降低Al2O3的熔融温度 | |
| D. | 洗衣粉中添加三聚磷酸钠,增强去污的效果 |
17.已知AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |
4.下列说法正确的是( )
| A. | C8H16与甲烷互为同系物 | |
| B. | 乙烯只能加成、不能取代,苯只能取代、不能加成 | |
| C. | CH3CH2CH2CH3和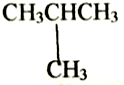 互为同分异构体 互为同分异构体 | |
| D. | 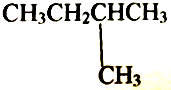 和 和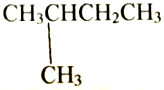 互为同分异构体 互为同分异构体 |
14.下列表述不正确的是( )
| A. | 福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 | |
| B. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 | |
| C. | 除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 | |
| D. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
20.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
| A. | 有机物一定含有碳元素,所以含碳元素的化合物一定是有机物 | |
| B. | 置换反应中有单质生成,所以有单质生成的反应一定属于置换反应 | |
| C. | 含碳元素的物质在O2中充分燃烧会生成CO2,所以在O2中燃烧能生成CO2的物质一定含碳元素 | |
| D. | 盐的组成中含有金属阳离子与酸根离子,所以盐中一定不含氢元素 |