题目内容
12.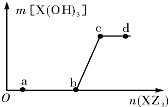 向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | d点对应的溶液中:K+、NH4+、CO32-、I- | |
| B. | c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ | |
| C. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| D. | a点对应的溶液中:Na+、K+、SO42-、HCO3- |
分析 A.d点为氯化铝溶液,碳酸根离子与铝离子发生双水解反应;
B.c点偏铝酸钠与氯化铝恰好完全反应生成氢氧化铝,溶液中存在氯离子,氯离子与银离子反应生成氯化银沉淀;
C.b点恰好生成偏铝酸钠,四种离子之间不反应,都不与偏铝酸钠反应;
D.a点溶液显碱性,NaOH过量,碳酸氢根离子能够与氢氧根离子反应.
解答 解:A.d点为氯化铝溶液,Al3+、CO32-相互促进水解生成沉淀和气体,在溶液中不能大量共存,故A错误;
B.c点偏铝酸钠与氯化铝恰好完全反应生成氢氧化铝,还生成氯化钠,则不可能存在Ag+,故B错误;
C.b点恰好生成偏铝酸钠,溶液显碱性,Na+、S2-、SO42-、Cl-离子之间不反应,都不与偏铝酸钠反应,在溶液中能够大量共存,故C正确;
D.a点溶液显碱性,NaOH过量,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,题目难度较大,明确图象中各点对应的反应及溶液的成分、离子之间的反应是解答的关键,注意选项A中的相互促进水解反应.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 只有共价键形成的分子一定是共价化合物 | |
| B. | 含有金属阳离子的晶体一定是离子晶体 | |
| C. | 元素的非金属性越强,其单质的活泼性一定越强 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
7.如图是CsCl晶体中的一个晶胞,相邻的两个Cs+的核间距为acm,NA为阿伏伽德罗常数,CsCl的相对分子质量用M表示,则CsCl晶体的密度为( )g/cm3


| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$ | B. | $\frac{6M}{{N}_{A}•{a}^{3}}$ | C. | $\frac{4M}{{N}_{A}•{a}^{3}}$ | D. | $\frac{M}{{N}_{A}•{a}^{3}}$ |
17.已知AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |
4.下列说法正确的是( )
| A. | C8H16与甲烷互为同系物 | |
| B. | 乙烯只能加成、不能取代,苯只能取代、不能加成 | |
| C. | CH3CH2CH2CH3和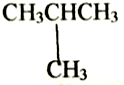 互为同分异构体 互为同分异构体 | |
| D. | 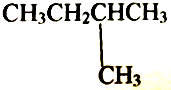 和 和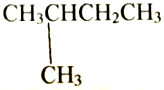 互为同分异构体 互为同分异构体 |
3.X、Y、Z为短周期元素,X的单质与水在常温条件下就能剧烈反应生成一种还原性气体,Y的最高价氧化物对应的水化物是一种酸性最强的酸;Z与Y同周期且只能形成ZY3;X、Z的简单离子核外电子排布相同.下列有关叙述正确的是( )
| A. | 离子半径:X>Y>Z | B. | 最外层电子数:Y>Z>X | ||
| C. | 原子序数:Z>Y>X | D. | 单质熔点:X>Z>Y |