题目内容
8.下列对相应微粒的描述中,不正确的是( )| A. | 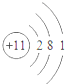 易形成阳离子 | B. | 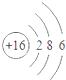 易得电子 | C. |  为稳定结构 | D. | 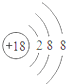 稀有气体的原子 |
分析 原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若粒子的最外层电子数为8,则为稀有气体元素,属于相对稳定结构;若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
解答 解:A、该原子的最外层电子数是1,小于4,在化学反应中易失去1个电子而形成阳离子,故A正确.
B、该原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成阴离子,故B正确.
C、该原子的最外层电子数是2,小于4,在化学反应中易失去2个电子而形成阳离子,故C错误.
D、该原子的最外层电子数为8,为稀有气体元素,属于相对稳定结构,故D正确.
故选:C.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,了解粒子结构示意图的意义是正确解题的关键.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
18.下列给出14种元素的电负性:
请运用元素周期律知识完成下列各题.
(1)同一周期中,从左到右,元素的电负性逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小.所以,元素的电负性随原子序数的递增呈周期性变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程: .
.
(3)表中符合“对角线规则”的元素有Li和Na、Be和Mg、B和Al,它们的性质分别有一定的相似性,其原因是处对角线上,写出Be(OH)2与强酸及强碱反应的离子方程式:Be(OH)2+2OH-=BeO22-+2H2O;.
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物Mg3N2、MgO、共价化合物SO2、AlCl3、CS2.
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(1)同一周期中,从左到右,元素的电负性逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小.所以,元素的电负性随原子序数的递增呈周期性变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程:
 .
.(3)表中符合“对角线规则”的元素有Li和Na、Be和Mg、B和Al,它们的性质分别有一定的相似性,其原因是处对角线上,写出Be(OH)2与强酸及强碱反应的离子方程式:Be(OH)2+2OH-=BeO22-+2H2O;.
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物Mg3N2、MgO、共价化合物SO2、AlCl3、CS2.
19.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 | |
| C. | 工业冶炼铝时电解Al2O3并加入冰晶石(Na3AlF6),是为了降低Al2O3的熔融温度 | |
| D. | 洗衣粉中添加三聚磷酸钠,增强去污的效果 |
16.蚂蚁会分泌一种信息素(化学式为C10H18O),下列说法正确的是( )
①该信息素由碳、氢、氧三种元素组成;
②该信息素中碳、氢、氧三种元素的质量比为10:18:1;
③该信息素是由多种原子构成的化合物;
④该信息素的一个分子中含有29个原子.
①该信息素由碳、氢、氧三种元素组成;
②该信息素中碳、氢、氧三种元素的质量比为10:18:1;
③该信息素是由多种原子构成的化合物;
④该信息素的一个分子中含有29个原子.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
13.某化学小组向AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,分别向滤渣和滤液中加入稀盐酸,均无明显现象,下列对滤渣和滤液的叙述中不正确的是( )
| A. | 滤液中一定有Zn(NO3)2 | B. | 滤渣中一定有Cu | ||
| C. | 滤液中一定没有AgNO3 | D. | 滤渣中一定有Ag |
17.已知AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |