题目内容
5.NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究的中的“明星分子”,回答下列问题.(1)在含有Cu+的酶的活化中心中,亚硝酸根离子(NO${\;}_{2}^{-}$)可转化为NO,写出Cu+和NO${\;}_{2}^{-}$在酸性水溶液中转换为NO的离子方程式:Cu++NO2-+2H+=Cu2++NO↑+H2O,反应中NO${\;}_{2}^{-}$表现出氧化性.
(2)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为3NO=N2O+NO2,若在同温同条件下完全转化时,容器内压强与转化前压强的比为2:3
(3)将0.05molNO、0.03molO2的混合气体以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质物质的量浓度为0.4mol•L-1(设溶液体积变化忽略不计)
分析 (1)Cu+具有还原性,NO2-具有氧化性,二者可发生氧化还原反应生成NO,NO2-是氧化剂,表现氧化性;
(2)红棕色气体是NO2,故有NO→N2O+NO2,配平后得:3NO=N2O+NO2,同温同体积时,气体压强比等于其物质的量之比,由此分析解答;
(3)在水中NO与O2反应为4NO+3O2+2H2O=4HNO3,进行计算.
解答 解:(1)Cu+具有还原性,NO2-具有氧化性,二者可发生氧化还原反应生成NO,反应的离子方程式为Cu++NO2-+2H+=Cu2++NO↑+H2O,NO2-是氧化剂,表现氧化性,
故答案为:Cu++NO2-+2H+=Cu2++NO↑+H2O,氧化;
(2)红棕色气体是NO2,故有NO→N2O+NO2,配平后得:3NO=N2O+NO2,同温同体积时,气体压强比等于其物质的量之比,故反应后与反应前容器中压强比为2:3,故答案为:3NO=N2O+NO2,2:3.
(3)在水中NO与O2反应为4NO+3O2+2H2O=4HNO3,0.05molNO和0.03molO2反应氧气不足,由此可求出生成的HNO3的物质的量为0.04mol,故所得硝酸浓度为0.4mol•L-1,故答案为:0.4mol•L-1.
点评 本题考查氮的氧化物的性质及其对环境的影响,化学方程式的书写和相关计算,题目难度不大,注意把握相关基础知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
15.某烃1mol最多能和2mol HCl加成,生成氯代烃,此氯代烃l mol能和6mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C4H6 |
16.蚂蚁会分泌一种信息素(化学式为C10H18O),下列说法正确的是( )
①该信息素由碳、氢、氧三种元素组成;
②该信息素中碳、氢、氧三种元素的质量比为10:18:1;
③该信息素是由多种原子构成的化合物;
④该信息素的一个分子中含有29个原子.
①该信息素由碳、氢、氧三种元素组成;
②该信息素中碳、氢、氧三种元素的质量比为10:18:1;
③该信息素是由多种原子构成的化合物;
④该信息素的一个分子中含有29个原子.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
13.某化学小组向AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,分别向滤渣和滤液中加入稀盐酸,均无明显现象,下列对滤渣和滤液的叙述中不正确的是( )
| A. | 滤液中一定有Zn(NO3)2 | B. | 滤渣中一定有Cu | ||
| C. | 滤液中一定没有AgNO3 | D. | 滤渣中一定有Ag |
10.生活中的一些问题常涉及化学知识,下列叙述正确的是( )
①使用明矾可软化硬水;
②硫酸钡难溶于水和酸,可做X光透视肠胃的药剂;
③铁制品在干燥的空气中容易生锈;
④医疗中消毒用的酒精是75%的乙醇溶液;
⑤棉花、蚕丝、人造羊毛的主要成分都是纤维素;
⑥福尔马林是混合物,可用来制作生物标本.
①使用明矾可软化硬水;
②硫酸钡难溶于水和酸,可做X光透视肠胃的药剂;
③铁制品在干燥的空气中容易生锈;
④医疗中消毒用的酒精是75%的乙醇溶液;
⑤棉花、蚕丝、人造羊毛的主要成分都是纤维素;
⑥福尔马林是混合物,可用来制作生物标本.
| A. | ①②③ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
17.已知AgCl的溶解度为1.5×10-4g,AgBr的溶解度为8.4×10-6g,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为( )
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |
14.下列表述不正确的是( )
| A. | 福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 | |
| B. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 | |
| C. | 除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 | |
| D. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
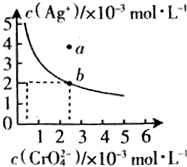 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.