题目内容
14.X、Y、Z、W是浓度均为0.01mol/L的溶液,其溶质分别是HCl、NH4Cl、NaOH、NaF中的某一种.室温下,溶液的pH如下表:下列说法正确的是( )| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
分析 图表分析,0.01mol/L的溶液PH,NaOH、HCl为强碱、强酸,NH4Cl、NaF为水解的盐,判断:X为NaOH,Y为HCl,Z为NaF,W为NH4Cl;
A、Z溶液PH=7.7溶液显碱性,是强碱弱酸盐水解显碱性,判断为NaF,稀释10倍水解平衡正向进行,PH变化小于1个单位;
B、酸碱抑制水的电离,水解的盐促进水的离子,Z为NaF,W为NH4Cl,促进水的电离,NaF溶液中水电离的氢离子浓度=$\frac{1{0}^{-14}}{1{0}^{-7.7}}$=10-6.3mol/L,NH4Cl溶液中水电离氢离子浓度=10-5.6mol/L;
C、将X、W溶液按1:2的体积比混合得到等浓度的NH3•H2O和NH4Cl溶液,一水合氨电离大于铵根离子水解;
D、氢氧化钠溶液和盐酸溶液反应,将11mLX溶液与9mLY溶液混合剩余氢氧化钠溶液,计算剩余氢氧根离子浓度计算溶液PH;
解答 解:图表分析,0.01mol/L的溶液PH,NaOH、HCl为强碱、强酸,NH4Cl、NaF为水解的盐,判断:X为NaOH,Y为HCl,Z为NaF,W为NH4Cl;
A、Z为NaF溶液,PH=7.7溶液显碱性,是强碱弱酸盐水解显碱性,稀释10倍水解平衡正向进行,PH变化小于1个单位,所得溶液pH>6.7,故A错误;
B、Z为NaF,W为NH4Cl,促进水的电离,酸碱抑制水的电离,水解的盐促进水的离子,NaF溶液中水电离的氢离子浓度=$\frac{1{0}^{-14}}{1{0}^{-7.7}}$=10-6.3mol/L,NH4Cl溶液中水电离氢离子浓度=10-5.6mol/L,水的电离程度最大的是NH4Cl溶液,故B正确;
C、将X、W溶液按1:2的体积比混合得到等浓度的NH3•H2O和NH4Cl溶液,一水合氨电离大于铵根离子水解,溶液显碱性,所得溶液中:c(H+)<c(OH-),故C错误;
D、氢氧化钠溶液和盐酸溶液反应,将11mLX溶液与9mLY溶液混合剩余氢氧化钠溶液,计算剩余氢氧根离子浓度=$\frac{11×0.01-9×0.01}{11+9}$=0.001mol/L,氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.001}$mol/L=10-11mol/L,溶液PH=11,故D错误;
故选B.
点评 本题考查了酸碱盐溶液中PH的分析判断,水的电离平衡影响因素分析,盐类水解的理解应用,注意算碱反应后溶液PH的计算,掌握基础是关键,题目难度中等.

| A. | 含氢氧化铁胶粒的分散系中可能大量存在H+,K+,S2-Br- | |
| B. | 高锰酸钾溶液中可能大量存在H+,Na+,SO42-,葡萄糖分子 | |
| C. | 弱碱性溶液中可能大存在Na+,K+,Cl-,HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+,K+,Cl-,SO42- |
| A. | 2NO2((g)+O3(g)?N2O5(g)+O2(g)中N2O5既是氧化产物又是还原产物 | |
| B. | aA(s)+bB(g)=cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
| 弱酸 | H2CO3 | 水杨酸(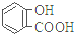 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于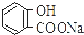 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 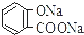 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 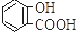 +2NaHCO3→ +2NaHCO3→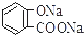 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| C. | 加快开发高效洁净能源转换技术,缓解能源危机 | |
| D. | “A PEC蓝”是2014年新的网络词汇,形容2014年A PEC会议期间北京蓝蓝的天空.说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 |
| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |
| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 2H2O2(l)=2H2O(l)+O2(g)△H=-98.2 kJ •mol-1,△S=70.5 J•mol-1•K-1,该反应低温能自发进行 | |
| C. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| D. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液 加入少量过氧化钠以上各离子量几乎不减 |
| A. | 1 L 0.1 mol/L Na2CO3溶液中,阴离子总数大于0.1 NA | |
| B. | 常温常压下,1 mol甘氨酸中含C-H键数目为3 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA | |
| D. | 50℃时,10 L pH=13的NaOH溶液中含有的OH-数目为NA |