题目内容
3.关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 2H2O2(l)=2H2O(l)+O2(g)△H=-98.2 kJ •mol-1,△S=70.5 J•mol-1•K-1,该反应低温能自发进行 | |
| C. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| D. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液 加入少量过氧化钠以上各离子量几乎不减 |
分析 A.根据过氧化钠的电子式为 计算;
计算;
B.根据△G=△H-T△S<0自发判断;
C.过氧化氢遇强氧化剂时,发生还原反应,根据化合价变化计算;
D.根据过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,据此分析.
解答 解:A.过氧化钠的电子式为 ,则7.8g过氧化钠含有的共用电子对为$\frac{7.8g}{78g/mol}$×1=0.1mol,故A错误;
,则7.8g过氧化钠含有的共用电子对为$\frac{7.8g}{78g/mol}$×1=0.1mol,故A错误;
B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2 kJ •mol-1,△S=70.5 J•mol-1•K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;
C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;
D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误.
故选B.
点评 本题主要考查了过氧化钠以及过氧化氢的性质,难度不大,抓住基础是关键.

练习册系列答案
相关题目
13.化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
14.X、Y、Z、W是浓度均为0.01mol/L的溶液,其溶质分别是HCl、NH4Cl、NaOH、NaF中的某一种.室温下,溶液的pH如下表:下列说法正确的是( )
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
18.用下列装置图进行相应的实验,其中正确的是( )
| A. | 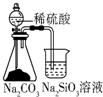 用如图可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 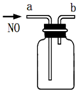 用如图装置收集一瓶纯净的NO | |
| C. |  用如图装置中U型管两端有液面差且保持不变时证明装置不漏气 | |
| D. | 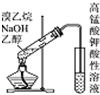 用如图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
15.下列说法不正确的是( )
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
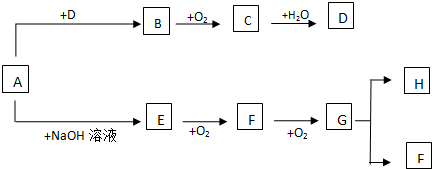
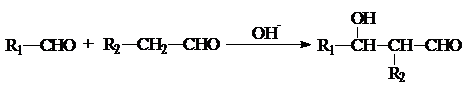 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下:
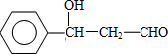 ,F 的结构简式是CH2OHCH2OH;
,F 的结构简式是CH2OHCH2OH;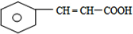 +CH2OHCH2OH$→_{△}^{浓硫酸}$
+CH2OHCH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;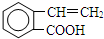
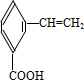 、
、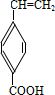 、
、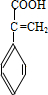 .
.
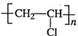 ,CH2C=HC-CN.
,CH2C=HC-CN.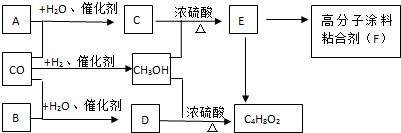
 .
.