题目内容
2.Ⅰ、A与SO2属于等电子体(即具有相同的原子总数和相同的最外层电子总数的微粒),常温下是一种无色的气体,当冷却到77K时,变成橙红色液体.A的一种制备方法是:在真空中,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B.(1)写出上述制备A的化学反应方程式CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$S2O+CuS.
(2)若将S2Cl2与CuO在100~400℃加热时也能生成A.写出相应的化学反应方程式S2Cl2+CuO$\frac{\underline{\;100℃-400℃\;}}{\;}$ S2O+CuCl2.
(3)A也能在水中发生歧化反应,生成两种常见的酸(但酸性不强).则这两种酸由强到弱的化学式分别为H2SO3和H2S.
Ⅱ、A是有机羧酸盐HCOONa,B、C、D是常见化合物;A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强.X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同.C受热分解得到Y、D和X;B与C反应生成D和X.E由两种元素组成,相对分子质量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g•L-1.
(1)E晶体中含有的化学键是离子键.
(2)X的沸点比同主族同类型物质要高,原因是水分子之间存在氢键.
(3)写出E与X反应的化学方程式Na3N+3H2O=3NaOH+NH3↑.
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式2Na++CO32-+H2O+CO2=2NaHCO3↓.
(5)A的一个重要应用是根据2A→P+H2↑得到P,P溶液中的阴离子通常用CaC12使之沉淀,P的化学式Na2C2O4,此反应是(填“是”或“否”)氧化还原反应.
分析 Ⅰ.(1)A与SO2属于等电子体,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B,分析元素组成,硫和氧化铜反应生成黑色固体是铜的化合物,判断为CuS,结合原子守恒和电子守恒配平化学方程式;
(2)将S2Cl2与CuO在100~400℃加热时也能生成A,依据(1)的判断A为S2O,结合原子守恒配平化学方程式;
(3)A也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强),说明是硫元素化合价升高和降低,升高为+4价,降低为-2价,对应酸为亚硫酸和氢硫酸;
Ⅱ、A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N,由此可解答问题.
解答 解:Ⅰ.(1)A与SO2属于等电子体,常温下是一种无色的气体,当冷却到77K时,变成橙红色液体.A的一种制备方法是:在真空中,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B,分析组成元素生成的黑色固体只能为CuS,原子守恒配平得到化学方程式为:CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$S2O+CuS;
故答案为:CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$S2O+CuS;
(2)将S2Cl2与CuO在100~400℃加热时也能生成S2O,硫元素、氧元素化合价不变,则发生的不是氧化还原反应,反应生成S2O和CuCl2,反应的化学方程式为:S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2;
故答案为:S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2;
(3)S2O也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强),说明是硫元素化合价升高和降低,升高为+4价,降低为-2价,对应酸为亚硫酸和氢硫酸,这两种酸由强到弱的化学式分别H2SO3,H2S;
故答案为:H2SO3;H2S;
Ⅱ、A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N,
(1)上述分析可知E为Na3N,含有离子键,故答案为:离子键;
(2)X为H2O,水分子之间存在氢键,沸点高于同主族同类型物质,故答案为:水分子之间存在氢键;
(3)E与X反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑,故答案为:Na3N+3H2O=3NaOH+NH3↑;
(4)D为Na2CO3,其饱和溶液中不断通入CO2,析出C为NaHCO3,反应的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
(5)反应2HCOONa→P+H2↑得到P,P溶液中的阴离子通常用CaC12使之沉淀,由守恒可知P为Na2C2O4,反应中有单质氢气生成,属于氧化还原反应,
故答案为:Na2C2O4;是.
点评 本题考查无机物推断,是对学生综合能力的考查,充分利用题目信息进行推断,物质性质和结构分析是关键,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
| 已知 | 类推 | |
| A | 离子是带电荷的粒子 | 带电荷的粒子一定是离子 |
| B | 稀硫酸作电解质溶液时,氢氧燃料电池的负极反应为 2H2-4e-=4H+ | 氢氧化钾溶液作电解质溶液时,氢氧燃料电池的负极反应为2H2-3e-+4OH-=4H2O |
| C | 将Fe加入到CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| D | 原电池中通常是活泼金属做负极,不活泼金属做正极 | 铜和铝与浓硝酸构成原电池时,铜是正极 |
| A. | A | B. | B | C. | C | D. | D |
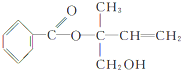 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
| A. | Al14有42个价电子,且与IIA族元素性质相似 | |
| B. | Al13有39个价电子,且与卤素性质类似 | |
| C. | Al13在气相中与HI反应可生成HAl13I,且化学方程式为 Al13+HI=HAl13I | |
| D. | Al13原子中A1原子间是通过离子键结合的 |
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
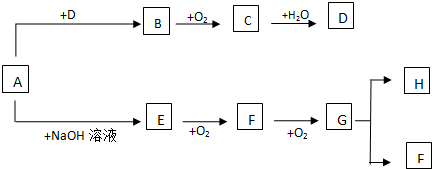

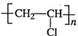 ,CH2C=HC-CN.
,CH2C=HC-CN.