题目内容
【题目】根据题意请回答有关氮的氧化物和氢化物的问题:
(1)随着人类社会的发展,氮氧化物的排放导致一系列问题。NO形成硝酸型酸雨的化学方程式为_______。一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.1 kJ·mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160.6 kJ·mol-1则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH= ___________ 。
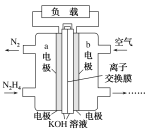
(2)肼(N2H4)可以用作燃料电池的原料。肼的电子式为_________,一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。b电极是_____极(填“正”或“负”),a电极的电极反应式:__________________。
(3)25 ℃时,Kb(NH3·H2O)=1.8×10-5 mol·L-1,向含a mol NH4NO3的溶液中滴加b L氨水呈中性,则所滴加氨水的浓度为___________。
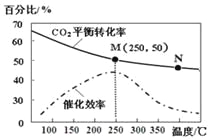
(4)在体积恒定的密闭容器中有可逆反应: 2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0 ,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150 ℃时,v(正)________v(逆)(填“>”或“<”)。
2NO2(g) ΔH<0 ,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150 ℃时,v(正)________v(逆)(填“>”或“<”)。
(5)判断在恒温恒容条件下该反应已达到平衡状态的是_____
A 2v正(NO2)=v逆(O2) B 反应容器中压强不随时间变化而变化
C 混合气体颜色深浅保持不变 D 混合气体平均相对分子质量保持不变
【答案】2NO+O2 = 2NO2 3 NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3)-867.35 kJ·mol-1 ![]() 正 N2H4+4OH--4e-=N2↑+4H2O
正 N2H4+4OH--4e-=N2↑+4H2O ![]() > BCD
> BCD
【解析】
(1)NO与氧气反应生成NO2,NO2与水反应生成硝酸;根据盖斯定律进行计算;
(2)N2H4相当于NH3中的1个H,换成NH。N-H之间,都是1对电子,2个N还有1对孤对电子;通入氧气的b电极是正极,a电极为负极;
(3)根据平衡常数K= ,计算得到c(NH3H2O);
,计算得到c(NH3H2O);
(4)根据图中信息可知,根据转化率判断平衡移动方向;
(5)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该.物理量由变化到定值时,说明可逆反应到达平衡状态。
(1)NO与氧气反应生成NO2,NO2与水反应生成硝酸,则NO形成硝酸型酸雨的化学方程式为2NO+O2 = 2NO2、3NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3);
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.1 kJ·mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160.6 kJ·mol-1 根据盖斯定律,由![]() (①+②)得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=
(①+②)得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=![]() (-574.1 kJ·mol-1-1160.6 kJ·mol-1)=-867.35 kJ·mol-1;
(-574.1 kJ·mol-1-1160.6 kJ·mol-1)=-867.35 kJ·mol-1;
(2)N2H4相当于NH3中的1个H,换成NH。N-H之间,都是1对电子,2个N还有1对孤对电子,其电子式为![]() ;
;
通入氧气的b电极是正极,氧气得电子产生氢氧根离子,a电极为负极,负极上N2H4失电子产生N2,其电极反应式为:N2H4+4OH--4e-=N2↑+4H2O;
(3)将amol NH4NO3溶于水,向该溶液滴加bL 氨水后溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-),NH3H2O的电离平衡常数取Kb=2×10-5 molL-1,设混合后溶液体积为1L,(NH4+)=c(NO3-)=amol/L;根据一水合氨电离平衡得到:NH3H2ONH4++OH-,平衡常数K= =
= =1.8×10-5 molL-1,计算得到c(NH3H2O)=
=1.8×10-5 molL-1,计算得到c(NH3H2O)=![]() mol/L;
mol/L;
(4)根据图中信息可知,150 ℃时,NO转化为NO2的转化率还在增大,则平衡正向移动,v(正)>v(逆);
(5)A. v正(NO2)=2v逆(O2)才能体现正逆反应速率相等,反应达平衡,选项A错误;
B.随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,选项B正确;
C.混合气体的颜色保持不变,说明二氧化氮的浓度不变,反应达平衡状态,选项C正确;
D.混合气体的平均相对分子质量保持不变,说明气体的物质的量不变,反应达平衡状态,选项D正确;
答案选BCD。.