题目内容
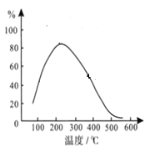
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ/mol,下列说法或表示式正确的是

A.金刚石的稳定性强于石墨
B.石墨和金刚石的转化是物理变化
C.C(s、石墨)=C(s、金刚石) ΔH=+1.9kJ·mol-1
D.断裂1 mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
【答案】C
【解析】
A.由图可知,1mol石墨所含能量低于1mol金刚石所含能量,所以石墨的稳定性强于金刚石,A错误;
B.石墨和金刚石的转化有新物质生成,属于化学变化,B错误;
C.由图可知,1mol石墨所含能量低于1mol金刚石所含能量,所以石墨转化为金刚石为吸热反应,ΔH为正,所以ΔH=-393.5kJ·mol-1-(-395.4kJ/mol)=+1.9kJ·mol-1,石墨转化为金刚石的热化学方程式为:C(s、石墨)=C(s、金刚石) ΔH=+1.9kJ·mol-1,C正确;
D.C(s、石墨)=C(s、金刚石)的ΔH>0,所以断裂1 mol石墨中的化学键吸收的能量比形成1mol金刚石中的化学键放出的能量多,所以,断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量多,D错误。
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】电化学手段对于研究物质性质以及工业生产中都有重要价值。
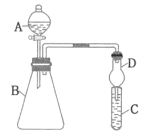
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
装置 | 实验现象 |
1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3 溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____。
(2)检验另一电极产物的操作及现象是_____。
(3)负极的电极反应式为_____。
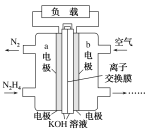
II. 工业上用 Na2SO4 溶液吸收工业烟气中的低浓度 SO2 形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

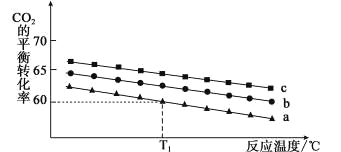
阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是 ____。
(5)阳极区 pH 降低的原因是____。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____。(写出一条即可)
【题目】某小组同学为研究 NaHCO3 溶液加热时的 pH 变化及其原因,在 10℃时加热NaHCO3 溶液,并记录 pH 如下:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到 50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的 pH 升高的原因是![]() 的水解程度增大,故碱性增强,NaHCO3发生水解反应的离子方程式是______。
的水解程度增大,故碱性增强,NaHCO3发生水解反应的离子方程式是______。
(2)乙同学认为,溶液 pH 升高的原因是NaHCO3 受热分解,生成了 Na2CO3,并推断 Na2CO3的水解程度_______________(填“>”或“<”)NaHCO3。
(3)丙、丁同学进行实验如下:
①丙:向少量加热煮沸的溶液和未经加热的溶液中分别加入足量的试剂 X 后,观察到前者产生大量白色沉淀,因此他认为______ (填“甲”或“乙”)的判断正确。其中试剂 X 是________(填序号)。
a.Ba(OH)2 溶液 b. BaCl2 溶液 c. NaOH 溶液 d. 澄清石灰水
②丁:将加热至 30℃的 NaHCO3 溶液恢复至 10℃,测其 pH=8.3。由此可得到的结论是__________。