题目内容
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
【答案】B
【解析】试题分析: A、正反应为体积减小的反应,增大压强,平衡正向移动,正反应是放热反应,降低温度平衡正向移动,A错误;B、正反应为体积增大的反应,增大压强,平衡逆向移动,正反应是吸热反应,降低温度平衡逆向移动,B正确;C、正反应为体积减小的反应,增大压强,平衡正向移动,正反应是放热反应,降低温度平衡正向移动,C错误;D、反应前后体积不变,增大压强平衡不移动,正反应是吸热反应,降低温度平衡逆向移动,D错误。答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g) = 2CO2(g) △ H = 566kJ/mol;2Fe(s)+![]() O2(g)= Fe2O3(s) △ H = 825.5kJ/mol
O2(g)= Fe2O3(s) △ H = 825.5kJ/mol
反应:Fe2O3(s) + 3CO(g)![]() 2Fe(s) + 3CO2(g) △H =_____kJ/mol。
2Fe(s) + 3CO2(g) △H =_____kJ/mol。
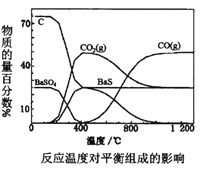
Ⅱ.反应 Fe2O3(s) + 3CO(g)![]() 2Fe(s) + 3CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
2Fe(s) + 3CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
(1)欲提高 CO 的平衡转化率,促进 Fe2O3的转化,可采取的措施是_____
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
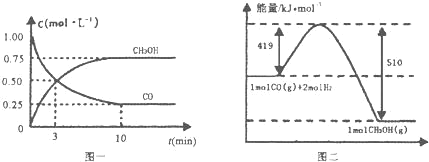
CO(g) + 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2) =_____。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化(Q1,Q2,Q3均大于 0) |
甲 | 1mol CO 和 2mol H2 | a1 | c1 | 放出Q1kJ 热量 |
乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ 热量 |
丙 | 2mol CO 和 4mol H2 | a3 | c3 | 放出Q3kJ 热量 |
则下列关系正确的是_____。
a. c1 = c2 b..2Q1 = Q3 c..2a1 = a3 d..a1+ a2= 1 e.该反应若生成1mol CH3OH,则放出(Q1 + Q2)kJ 热量
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
(7)写出⑥的单质置换出②的单质的化学方程式:________________________。