题目内容
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.1molNa与![]() 完全反应生成
完全反应生成![]() 和
和![]() 的混合物,转移电子
的混合物,转移电子![]() ,生成物中离子总数为
,生成物中离子总数为![]()
B.![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
![]() 个
个
C.![]() 里含有的电子数目为
里含有的电子数目为![]()
D.62g白磷中含有P-P键的数目为![]()
【答案】D
【解析】
A.钠和氧气反应后变为![]() 价,故1mol钠完全反应转移1mol电子即
价,故1mol钠完全反应转移1mol电子即![]() 个,而生成的产物无论是氧化钠还是过氧化钠,均是
个,而生成的产物无论是氧化钠还是过氧化钠,均是![]() 阴离子,而1mol钠反应后变为
阴离子,而1mol钠反应后变为![]() ,故所对应的阴离子的物质的量为
,故所对应的阴离子的物质的量为![]() ,即产物中离子共
,即产物中离子共![]() 个,故A错误;
个,故A错误;
B.![]() 的
的![]() 溶液中,
溶液中,![]() 的电离大于水解,故溶液中的氢离子主要来自于
的电离大于水解,故溶液中的氢离子主要来自于![]() 的电离,故溶液中水电离出的氢离子小于
的电离,故溶液中水电离出的氢离子小于![]() 个,故B错误;
个,故B错误;
C.![]() 的物质的量为
的物质的量为![]() ,而
,而![]() 中含8mol电子,故
中含8mol电子,故![]() 中含
中含![]() 电子即
电子即![]() 个,故C错误;
个,故C错误;
D.62g白磷![]() 的物质的量为
的物质的量为![]() ,而1mol白磷中含
,而1mol白磷中含![]() 键,故
键,故![]() 白磷中含
白磷中含![]() 键即
键即![]() 个,故D正确.
个,故D正确.
故选D。

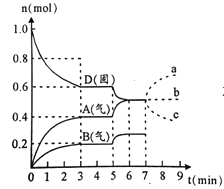
【题目】某小组同学为研究 NaHCO3 溶液加热时的 pH 变化及其原因,在 10℃时加热NaHCO3 溶液,并记录 pH 如下:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到 50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的 pH 升高的原因是![]() 的水解程度增大,故碱性增强,NaHCO3发生水解反应的离子方程式是______。
的水解程度增大,故碱性增强,NaHCO3发生水解反应的离子方程式是______。
(2)乙同学认为,溶液 pH 升高的原因是NaHCO3 受热分解,生成了 Na2CO3,并推断 Na2CO3的水解程度_______________(填“>”或“<”)NaHCO3。
(3)丙、丁同学进行实验如下:
①丙:向少量加热煮沸的溶液和未经加热的溶液中分别加入足量的试剂 X 后,观察到前者产生大量白色沉淀,因此他认为______ (填“甲”或“乙”)的判断正确。其中试剂 X 是________(填序号)。
a.Ba(OH)2 溶液 b. BaCl2 溶液 c. NaOH 溶液 d. 澄清石灰水
②丁:将加热至 30℃的 NaHCO3 溶液恢复至 10℃,测其 pH=8.3。由此可得到的结论是__________。
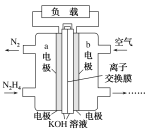
【题目】下表中实验操作、现象以及所得出的结论都正确的是![]()
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有 | 先出现白色沉淀,后出现黄色沉淀 |
|
B | 将适量 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是 |
C | 取少量 | 产生白色沉淀 |
|
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是 |
A.AB.BC.CD.D