题目内容
【题目】铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________。
【答案】第四周期,第Ⅷ族 3 3Fe2++ 2[Fe(CN)6]3- =2Fe3[Fe(CN)6]2 ↓ 2Fe(OH)3+6H+ +2I-=2Fe2++ I2+ 6H2O 2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42-+ 5H2O + 3Cl-
(或2 Fe3++ 3ClO-+ 10OH-=2FeO42-+ 5H2O + 3Cl-) Fe3O4
【解析】
(1)根据元素在周期表中的位置进行判断;
(2)依据离子交换关系氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,依据0.54g FeClx中氯离子物质的量计算x值;
(3)根据反应书写离子方程式;
(4)FeCl3与氢碘酸发生氧化还原反应,生成棕色物质碘和亚铁离子;
(5)FeCl3与KClO在强碱性条件下发生氧化还原反应生成高铁酸钾、氯化钾、和水,结合得失电子守恒写出方程式;
(6)计算草酸亚铁的物质的量,求出铁元素的物质的量,再确定0.773g铁的氧化物中氧元素的质量,再计算氧元素的物质的量,通过确定铁和氧的原子数来确定氧化物的化学式。
(1)铁是26号元素,在元素周期表中的位置为第四周期Ⅷ族;
(2)n(Cl)=n(H+)=n(OH-)=0.0250L×0.40 molL-1=0.010 mol,0.54g FeClx样品中含有氯离子物质的量为![]() =0.010 mol,解得x=3;
=0.010 mol,解得x=3;
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,Fe2+与Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2 沉淀,反应的离子方程式为3Fe2++ 2[Fe(CN)6]3- =2Fe3[Fe(CN)6]2 ↓;
(4)FeCl3与氢碘酸发生氧化还原反应,生成棕色物质碘和亚铁离子,方程式为2Fe3++2I-═2Fe2++I2;
(5)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(6)1.44g草酸亚铁的物质的量为![]() =0.01mol,n(Fe)=n(FeC2O4)=0.01mol,m(Fe)= 0.01mol
=0.01mol,n(Fe)=n(FeC2O4)=0.01mol,m(Fe)= 0.01mol![]() 56g/mol=0.56g,0.773g铁的氧化物中m(O)=0.773g-0.56g=0.213g,n(O)=
56g/mol=0.56g,0.773g铁的氧化物中m(O)=0.773g-0.56g=0.213g,n(O)= ![]() =0.0133mol,n(Fe):n(O)=0.01mol:0.0133mol=3:4,故该铁的氧化物的化学式为Fe3O4。
=0.0133mol,n(Fe):n(O)=0.01mol:0.0133mol=3:4,故该铁的氧化物的化学式为Fe3O4。

【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
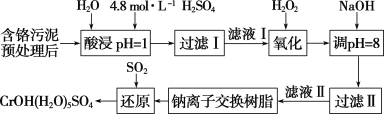
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)配制500mL4.8mol/L的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要______。
(2)酸浸时,为了提高浸取率可采取的措施有________、________。(答出两点)
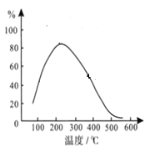
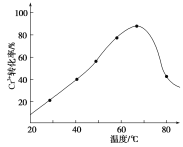
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O![]() ,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是_________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度约为1 mol·L-1)________(填 “是”或“否”)。已知Ksp[Mg(OH)2]=1.8×10-11。
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原反应生成CrOH(H2O)5SO4沉淀的离子方程式 _________。
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出向CrCl3溶液中逐滴加NaOH溶液至过量的离子方程式_____________。
【题目】下表中实验操作、现象以及所得出的结论都正确的是![]()
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有 | 先出现白色沉淀,后出现黄色沉淀 |
|
B | 将适量 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是 |
C | 取少量 | 产生白色沉淀 |
|
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是 |
A.AB.BC.CD.D