题目内容
17.某元素原子M层电子数比L层电子数少1个,该元素的最高正价为( )| A. | +7 | B. | +5 | C. | +3 | D. | 无最高正价 |
分析 某元素的原子M层电子数比L层电子数少1个,根据构造原理,排满L层再排M层,K层2个电子,L层最多为8个电子,则M层为8-1=7个电子,共有17个电子,核电荷数为17,是Cl元素,该元素的最高正化合价为最外层电子数,据此分析.
解答 解:多电子原子核外电子分层排布:K层有1个轨道(叫s轨道),1个轨道最多可以容纳自旋方向相反的2个电子;L层有4个轨道(1个s轨道,3个p轨道),共8电子;某元素的原子M层电子数比L层电子数少1个,根据构造原理,排满L层再排M层,K层2个电子,L层最多为8个电子,则M层为8-1=7个电子,共有17个电子,核电荷数为17,是Cl元素,该元素的最高正化合价为最外层电子数,所以该元素的最高正化合价为+7,
故选A.
点评 本题考查结构性质位置关系,比较基础,确定元素是解题关键,注意掌握掌握核外电子排布规律与一些元素的特殊性,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
7.1mol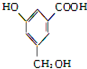 分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )
分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )
 分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )
分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )| A. | 1:1:1 | B. | 1:3:2 | C. | 2:3:1 | D. | 1:2:3 |
12.已知一氯戊烷有8种同分异构体,C5H12O中既能发生消去反应又能发生催化氧化的醇类的同分异构体数目是( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
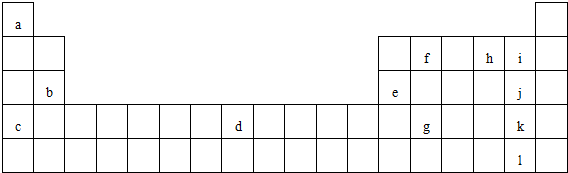
2. X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A. | X与Q形成的化合物中含有共价键 | |
| B. | 最高价氧化物对应水化物的酸性:Q比Z弱 | |
| C. | 14X和14Y具有相同的质量数,互为同位素 | |
| D. | Q与O2反应生成的化合物中,Q元素显+6价 |
9.下列说法中,不正确的是( )
| A. | HCl稳定性比HI好 | |
| B. | CH4的沸点比NH3的沸点低 | |
| C. | Mg失电子能力比Ca弱 | |
| D. | NaCl与NH4Cl含有的化学键类型完全相同 |
6.某原电池的离子方程式是 Zn+Cu2+=Zn2++Cu,该原电池正确的组成是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Zn | Cu | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |