题目内容
2. X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A. | X与Q形成的化合物中含有共价键 | |
| B. | 最高价氧化物对应水化物的酸性:Q比Z弱 | |
| C. | 14X和14Y具有相同的质量数,互为同位素 | |
| D. | Q与O2反应生成的化合物中,Q元素显+6价 |
分析 根据元素在周期表中的位置知,X和Y位于第二周期、Z和Q位于第三周期,若X原子的最外层电子是内层电子数的2倍,其内层电子数是2,X原子最外层电子数是4,为C元素,则Y、Z、Q分别是N、P、S元素,
A.非金属元素之间易形成共价键;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.质子数相同、中子数不同的同一元素不同原子互称同位素;
D.Q与O2反应生成的化合物SO2中,Q元素显+4价.
解答 解:根据元素在周期表中的位置知,X和Y位于第二周期、Z和Q位于第三周期,若X原子的最外层电子是内层电子数的2倍,其内层电子数是2,X原子最外层电子数是4,为C元素,则Y、Z、Q分别是N、P、S元素,
A.非金属元素之间易形成共价键,X与Q形成的化合物CS2中C-S原子之间只存在共价键,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Q>Z,所以最高价氧化物对应水化物的酸性:Q比Z强,故B错误;
C.14X和14Y具有相同的质量数但质子数不同,所以不互为同位素,故C错误;
D.Q与O2反应生成的化合物SO2中,O元素显-2价、Q元素显+4价,故D错误;
故选A.
点评 本题考查原子结构和元素性质,涉及原子结构、元素周期表结构、物质结构及基本概念,正确判断元素是解本题关键,知道非金属性强弱与其最高价含氧酸酸性强弱关系,易错选项是C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.在乙醇发生的各种反应中,断键方式不正确的是( )
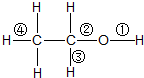

| A. | 与金属钠反应时,键①断裂 | |
| B. | 与HCl反应生成氯乙烷时,键②断裂 | |
| C. | 与醋酸、浓硫酸共热时,键②断裂 | |
| D. | 与浓硫酸共热至170℃时,键②和④断裂 |
10.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | X2Z与X2M比较,稳定性:X2Z>X2M |
17.某元素原子M层电子数比L层电子数少1个,该元素的最高正价为( )
| A. | +7 | B. | +5 | C. | +3 | D. | 无最高正价 |
7.对现代元素周期表的提出做出最重要贡献的科学家是( )
| A. | 门捷列夫(俄国) | B. | 纽兰兹(英国) | C. | 迈耶尔(德国) | D. | 拉瓦锡(法国) |
11.反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的化学反应速率为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
 A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.
A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.
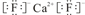 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).