题目内容
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
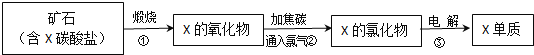
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:
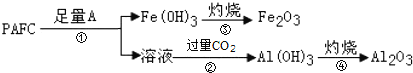
试剂A是____,步骤②中发生反应的离子方程式是____。
【答案】-1 35 汞作催化剂加速了铝的氧化反应 用汞和除去氧化膜的铝片在干燥的空气中作对比实验 Al2O3+3Cl2+3C=2AlCl3+3CO 强酸性和强碱性溶液中三价铁、三价铝离子无法形成相应胶体 氢氧化钠溶液 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
(1)①因为镁为+2价,又化合物的化合价代数和为0,所以MgH2中氢元素的化合价为-1价,故答案为:-1;
②混合物X(17MgH2+12Al)与足量的NaOH溶液混合,铝与氢氧化钠反应还生成氢气,其方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,又766gX中含铝的物质的量为![]() ×12mol=12mol,所以生成氢气为
×12mol=12mol,所以生成氢气为![]() ×3mol=18mol,又766gX中含MgH2的物质的量为
×3mol=18mol,又766gX中含MgH2的物质的量为![]() ×17mol=17mol,所以一共可以达到(18+17)=35molH2,故答案为:35;
×17mol=17mol,所以一共可以达到(18+17)=35molH2,故答案为:35;
(2)因为加快反应速率,一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是汞作催化剂加速了铝的氧化反应;用汞和除去氧化膜的铝片在干燥的空气中作对比实验,如果铝片表面没有会迅速长出胡须状的“白毛”,则为铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应,反之则不是,故答案为:汞作催化剂加速了铝的氧化反应;用汞和除去氧化膜的铝片在干燥的空气中作对比实验;
(3)因为工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体根据原子守恒则为CO,所以方程式为Al2O3+3Cl2+3C=2AlCl3+3CO;故答案为:Al2O3+3Cl2+3C=2AlCl3+3CO;
(4)①因为三价铁、三价铝离子在水中发生水解生成氢氧化铁和氢氧化铝的胶体吸附水中悬浮杂质净水,在强酸性和强碱性溶液中三价铁、三价铝离子无法发生水解生成相应胶体,所以均会失去净水作用;故答案为:强酸性和强碱性溶液中三价铁、三价铝离子无法形成相应胶体;
②为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液,过滤后得到氢氧化铁,灼烧得到氧化铁,滤液中通入过量二氧化碳气体,反应生成氢氧化铝沉淀,灼烧得到氧化铝;所以试剂A为氢氧化钠溶液,步骤②中的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;故答案为:氢氧化钠溶液,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。