题目内容
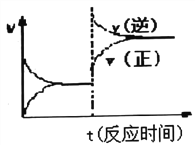
【题目】实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是()。
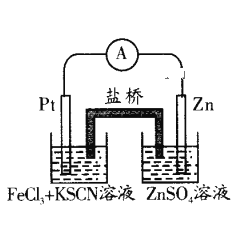
A.该原电池的正极反应:Zn-2e-=Zn2+
B.左边烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡生成
D.该电池总反应:3Zn+2Fe3+=2Fe+3Zn2+
【答案】B
【解析】
Zn失去电子发生氧化反应,为负极反应,Fe3+在正极得电子被还原为Fe2+,以此解答。
A.Zn失去电子发生氧化反应,为负极反应,A错误;
B.Fe3+在正极得电子被还原为Fe2+,溶液红色褪去,B正确;
C.铂电极上Fe3+被还原为Fe2+,没有气体生成,C错误;
D.在负极Zn失去电子,变为Zn2+,Fe3+得到电子变为Fe2+,电池总反应为:Zn+2Fe3+=2Fe2++Zn2+,并没有单质生成,D错误;
故合理选项是B。

练习册系列答案
相关题目