题目内容
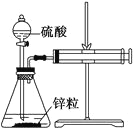
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
【答案】C
【解析】
0℃、101kPa为标况条件下,气体摩尔体积为22.4L/mol;化学反应速率,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示;根据Zn+2H+=Zn2++H2↑反应,可算出用各物质表示的10s内该反应的速率。
0℃、101kPa条件下的H2体积为44.8mL,其物质的量为0.002mol,则根据Zn+H2SO4=ZnSO4+H2↑反应可知:Zn--H2SO4--ZnSO4---H2,n(Zn)= n(H2SO4)= n(ZnSO4)= n(H2)= 0.002mol;m(Zn)=0.002mol×65g/mol=0.13g,v(Zn)=0.13/10=0.013g/s,v(H+)=0.002×2/0.04×10=0.01mol/(L·s),v(Zn2+)=0.002/0.04×10=0.005mol/(L·s),v(H2)=0.002/10=0.0002mol/s;
A、用锌粒来表示10s内该反应的速率为0.013g/s,正确;
B、用H+来表示10s内该反应的速率0.01mol/(L·s),正确;
C、用Zn2+来表示10s内该反应的速率0.005mol/(L·s),错误;
D、用H2来表示10s内该反应的速率为0.0002mol/s,正确;
综上所述,本题选C。