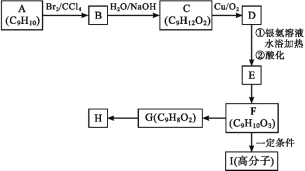
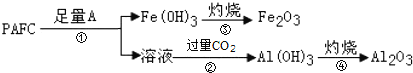
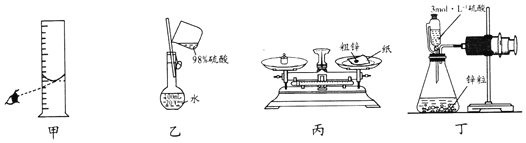
题目内容
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
A.1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量
B.形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量
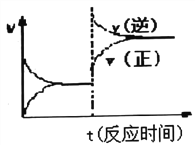
C.加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本
D.将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量
【答案】D
【解析】
A.已知:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol。反应是放热反应,依据能量守恒,反应物总能量大于生成物总能量,1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量,故A正确;
B.反应是放热反应,断裂化学键吸收能量,形成化学键放出能量,依据能量守恒,形成2molNH3(g)的化学键释放的总能量大于断裂1molN2(g)和3molH2(g)的化学键所吸收的总能量,故B正确;
C.加入催化剂是为了加大反应速率,缩短达到平衡所需时间,降低生产成本,故C正确;
D.反应是可逆反应不能进行彻底;将1 mol N2(g) 和3 mol H2(g) 充入一密闭容器中反应,放出的热量小于92.4 kJ,故D错误;
故答案为D。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目