题目内容
【题目】关于下列各装置图的叙述不正确的是
A.用图 装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
B.图 表示反应2SO2(g)+O2(g)
表示反应2SO2(g)+O2(g) ![]() 2SO3(g)增大O2的浓度对反应速率的影响
2SO3(g)增大O2的浓度对反应速率的影响
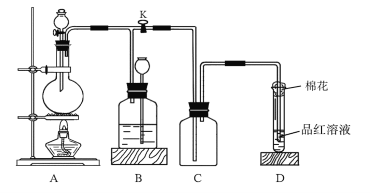
C.图 表示中和热测定的实验装置图
表示中和热测定的实验装置图
D.图 装置盐桥中KCl的Cl-移向左烧杯
装置盐桥中KCl的Cl-移向左烧杯
【答案】C
【解析】
A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为可溶性铜盐,根据电流方向知,a为阳极、b为阴极,则a为粗铜、b为纯铜,粗铜中还有其它金属失电子进入电解质溶液、纯铜上析出Cu,则溶解的Cu质量小于析出Cu的质量,所以硫酸铜溶液浓度减小,故A正确;
B.2SO2(g)+O2(g) ![]() 2SO3(g),增大O2的浓度,反应物浓度突然增大,正反应速率突然,生成物浓度不变,逆反应速率不变,随着反应的进行,正反应速率减小,逆反应速率增大,重新建立平衡,与图像吻合,故B正确;
2SO3(g),增大O2的浓度,反应物浓度突然增大,正反应速率突然,生成物浓度不变,逆反应速率不变,随着反应的进行,正反应速率减小,逆反应速率增大,重新建立平衡,与图像吻合,故B正确;
C.该装置中缺少搅拌仪器——环形玻璃搅拌棒,且烧杯口未用纸板覆盖,无法达到实验目的,故C错误;
D.该装置中锌为负极,铜为正极,原电池中阴离子性负极移动,因此装置的盐桥中KCl的Cl-移向左烧杯,故D正确;
故选C。

【题目】下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
B | 向FeCl3+3KSCN | 体系颜色无变化 | KCl不能使该平衡移动 |
C | 向浓度均为0.1mol·L-1NaOH和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
A.AB.BC.CD.D