题目内容
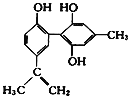
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
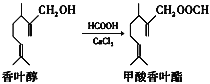
A.香叶醇的分子式为C11H18O
B.香叶醇在浓硫酸、加热条件下可发生消去反应
C.1 mol甲酸香叶酯可以与3 mol H2发生加成反应
D.甲酸香叶酯与新制的Cu(OH)2悬浊液共热可生成红色沉淀
【答案】D
【解析】
A.由结构简式可知分子式为C11H20O,故A错误;
B.香叶醇中与-OH相连的C的邻位C上没有H原子,则不能发生消去反应,故B错误;
C.1mol甲酸香叶酯中含2molC=C,则可以与2molH2发生加成反应,故C错误;
D.甲酸香叶酯分子结构中含有醛基,可与新制的Cu(OH)2悬浊液共热可生成红色沉淀,故D正确;
故答案为D。

 阅读快车系列答案
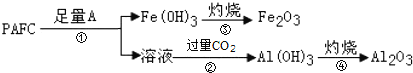
阅读快车系列答案【题目】Ⅰ.高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的离子方程式:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+__。K2FeO4在处理水的过程中所起的作用是___和____。
4Fe(OH)3+8OH-+__。K2FeO4在处理水的过程中所起的作用是___和____。
(2)将适量K2FeO4配制成c(FeO42-)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是___,发生反应的ΔH___0。

Ⅱ.下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 平衡方程式 | 平衡常数K | Ksp |
CH3COOH | CH3COOH | 1.76×10-5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-4 K2=5.61×10-11 | |
C6H5OH | C6H5OH | 1.1×10-10 | |
H3PO4 | H3PO4 H2PO4- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3·H2O | NH3·H2O | 1.76×10-5 | |
BaSO4 | BaSO4 | 1.07×10-10 | |
BaCO3 | BaCO3 | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为___(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式___。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)__c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol·L-1苯酚溶液中滴加VmL0.01mol·L-1氨水,混合液中粒子浓度关系正确的是__。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol·L-1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(NH4
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:___。