题目内容
【题目】有X、Y、Z和W四种元素.已知:①![]() 、Y、Z属同一短周期,其离子以
、Y、Z属同一短周期,其离子以![]() 、
、![]() 、
、![]() 的形式存在。②
的形式存在。②![]() 和Z组成化合物
和Z组成化合物![]() 溶液遇苯酚呈紫色。请回答:
溶液遇苯酚呈紫色。请回答:
(1)Z的最高价氧化物对应水化物的名称为 ______
(2)X的单质在二氧化碳中燃烧的化学方程式为 ______
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式 ______,Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因______
(4)当有![]() W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 ______ L
W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 ______ L
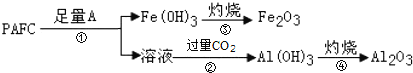
(5)我国陆地上冶炼X的主要流程如图所示:
 已知当有lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为 ______
已知当有lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为 ______
【答案】高氯酸 2Mg+CO2![]() 2MgO+C 3MnO2+4Al
2MgO+C 3MnO2+4Al![]() 2Al2O3+3Mn 在氢氧化铝中存在电离平衡
2Al2O3+3Mn 在氢氧化铝中存在电离平衡![]() ,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解
,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解 ![]()
![]()
【解析】
W和Z组成化合物![]() 溶液遇苯酚呈紫色,则W为Fe、Z为Cl;
溶液遇苯酚呈紫色,则W为Fe、Z为Cl; ![]() 、Y、Z属同一短周期元素,其离子以
、Y、Z属同一短周期元素,其离子以![]() 、
、![]() 、
、![]() 的形式存在,则
的形式存在,则![]() 、Y分别是Mg、Al元素。
、Y分别是Mg、Al元素。
(1)Z是Cl元素,氯元素的最高化合价为![]() 价,对应的最高价氧化物的水化物为
价,对应的最高价氧化物的水化物为![]() ,其名称为高氯酸;
,其名称为高氯酸;
(2)X是镁元素,镁与二氧化碳反应生成氧化镁和碳,反应方程式为2Mg+CO2![]() 2MgO+C;
2MgO+C;
(3)铝与二氧化锰反应生成氧化铝和锰,其反应为3MnO2+4Al![]() 2Al2O3+3Mn,氢氧化铝存在电离平衡
2Al2O3+3Mn,氢氧化铝存在电离平衡![]() ,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;
,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;
(4)![]() 的物质的量为
的物质的量为![]() ,设生成氢气的体积为V;
,设生成氢气的体积为V;
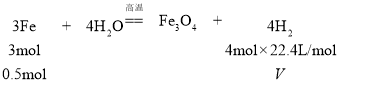
![]()
V=14.9L;
(5)由流程图中的反应②可知,氧化镁与碳和氯气反应生成氯化镁和碳的氧化物,lmolMgO参加反应时,有2mol电子转移且生成三种产物,即1mol氯气作氧化剂时,![]() 碳作还原剂,且生成均为
碳作还原剂,且生成均为![]() 的
的![]() 和CO,其反应为
和CO,其反应为![]() 。
。

 中考解读考点精练系列答案
中考解读考点精练系列答案