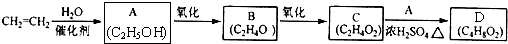题目内容
18.化学与生产、生活、社会密切相关.下列说法中不正确的是( )| A. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 合金材料中可能含有非金属元素 |
分析 A.根据铁在潮湿的空气生锈是由于发生电化学腐蚀;
B.可降解塑料分解产生CO2,CO2又合成聚碳酸酯可降解塑料;
C.根据可回收利用垃圾:废弃金属、废纸、废弃玻璃、废弃塑料、废弃电池;
D.根据合金就是某种金属与其他一种或几种金属或非金属融合在一起形成的混合物来分析.
解答 解:A.铁在潮湿的空气中放置,易发生电化学腐蚀而生锈,故A错误;
B.可降解塑料分解产生CO2,CO2又合成聚碳酸酯可降解塑料,实现“碳”的循环利用,故B正确;
C.废弃的玻璃、金属、纸制品是可回收利用的资源,故C正确;
D.合金就是某种金属与其他一种或几种金属或非金属融合在一起形成的混合物,所以合金中肯定含有金属、可能含有非金属,故D正确;
故选:A.
点评 本题主要考查低碳经济,垃圾回收,金属的腐蚀、合金等,平时注意知识的积累,难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
9.氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
则反应CO(g)+$\frac{1}{2}$O2(g)═CO2(g)的△H=-283 kJ•mol-1
(3)在固定体积的密闭容器中,1.0×103kPa时,发生反应 N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①K1>K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是bc(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2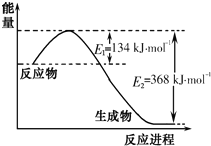
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变.
(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
则反应CO(g)+$\frac{1}{2}$O2(g)═CO2(g)的△H=-283 kJ•mol-1
(3)在固定体积的密闭容器中,1.0×103kPa时,发生反应 N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
②下列各项能说明上述合成氨反应一定达到平衡状态的是bc(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2

b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变.
6.下列卤代烃中,能发生消去反应且能生成两种单烯烃的是( )
| A. | 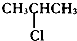 | B. | CH3CH2Cl | C. | 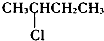 | D. | CH3CH2CH2Cl |
13.下列离子方程式中,正确的是( )
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- |
3.短周期主族元素X、Y、Z的原子序数依次增大,在周期表中分处三个不同周期.X与Z同主族,X与Z的原子序数之和为12.下列说法中不正确的是( )
| A. | 离子半径 Z>X | B. | 最外层电子数 Z>Y | ||
| C. | 金属性 Z>X | D. | 原子半径 Z>Y |
10.下列物质中,不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②乙烷 ③乙苯 ④二氧化硫 ⑤聚乙烯 ⑥甲苯 ⑦苯 ⑧异戊二烯.
①乙烯 ②乙烷 ③乙苯 ④二氧化硫 ⑤聚乙烯 ⑥甲苯 ⑦苯 ⑧异戊二烯.
| A. | ②③⑥ | B. | ②③⑤⑥⑦⑧ | C. | ②⑤⑦ | D. | ②⑦ |