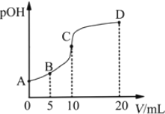
题目内容
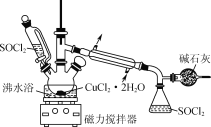
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH 和水形成的混合液,通入 SO2 时发生反应生成保险粉和一种常见气体,下列说法错误的是( )
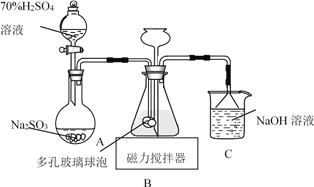
A.制备保险粉的离子方程式为:HCOO-+OH-+2SO2=S2O42-+CO2↑+H2O
B.多孔玻璃球泡的作用是增大气体与溶液的接触面积,使 SO2 能被充分吸收
C.NaOH 溶液的主要作用是吸收逸出的CO2
D.为避免 Na2S2O4 被 O2 氧化,使硫酸与亚硫酸钠先反应,产生的 SO2 排出装置中的 O2
【答案】C
【解析】
A装置中,Na2SO3与70% 的硫酸发生复分解反应,生成Na2SO4、H2O和SO2;生成的SO2进入B装置,与HCOONa、NaOH、CH3OH 和水形成的混合液发生反应,从而生成Na2S2O4,另一产物应为CO2;未反应的SO2用NaOH溶液吸收。
A.制备保险粉时,HCOO-、OH-与通入的SO2发生反应生成S2O42-、CO2和H2O,A正确;
B.多孔玻璃球泡使SO2气体与混合溶液多方接触,从而增大接触面积,加快反应速率,最终达到充分吸收SO2的目的,B正确;
C.NaOH 溶液的主要作用是吸收逸出的SO2,C错误;
D.先让硫酸与亚硫酸钠发生反应,利用产生的 SO2 将装置中的 O2排出,防止Na2S2O4 被氧化,D正确;
故选C。

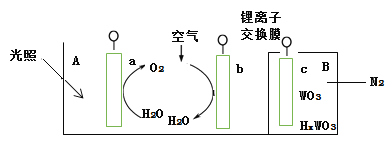
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
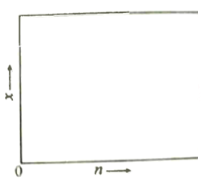
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
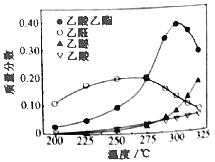
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键