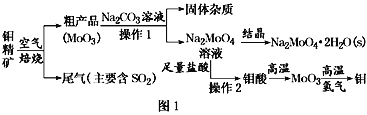
题目内容
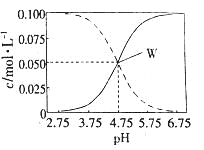
【题目】室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是
 [
[
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)+c(OH-)
B.向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l
D.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)-
【答案】D
【解析】
A. 醋酸钠的含量越大溶液pH越大,根据图示,图中实线表示c(CH3COO-)、虚线表示c(CH3COOH);pH=5.5的溶液中:c(CH3COOH)<c(CH3COO-),故A错误;
B. W点c(CH3COOH)= c(CH3COO-),向W点所表示的1.0L溶液中通人0.05molHCl气体后,c(CH3COOH)>0.05mol/L,c(H+)<c(CH3COOH),故B错误;
C. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol.L-l,故C错误;
D. W点所表示的溶液中c(CH3COOH)= c(CH3COO-),根据电荷守恒:故c(Na+)+c(H+)=c(CH3COO-)+c(OH)-,c(Na+)+c(H+)=c(CH3COOH)+c(OH)-,D正确。
答案选D。

练习册系列答案
相关题目