题目内容
【题目】甲胺(CH3NH2)的性质与氨气相似。已知pKb=-lgKb,pKb(CH3NH2·H2O)=3.4,pKb(NH3·H2O)=4.8。常温下,向10.00 mL 0. 1000 mol·L-1的甲胺溶液中滴加0. 0500 mol·L-1的稀硫酸,溶液中c(OH-)的负对数pOH=-lgc(OH-)]与所加稀硫酸溶液的体积(V)的关系如图所示。下列说法错误的是
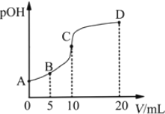
A.B点对应的溶液的pOH>3.4
B.甲胺溶于水后存在平衡:CH3NH2+H2O![]() CH3NH
CH3NH![]() +OH-
+OH-
C.A、B、C三点对应的溶液中,水电离出来的c(H+):C>B>A
D.A、B、C、D四点对应的溶液中,c(CH3NH3+)的大小顺序:D>C>B>A
【答案】D
【解析】
A.B点加入5 mL0.0500 mol/L的稀硫酸,不考虑水解和电离,反应后c(CH3NH3+)=c(CH3NH2),由于pKb(CH3NH2·H2O)=3.4,CH3NH2H2O的电离程度大于CH3NH3+的水解程度,则溶液中c(CH3NH3+)>c(CH3NH2);
B.甲胺(CH3NH2)的性质与氨气相似,说明CH3NH2H2O是一元弱碱,可以部分电离出氢氧根离子;
C.恰好反应时水的电离程度最大,碱过量抑制了水的电离,碱的浓度越大抑制程度越大;
D.C、D点相比,n(CH3NH3+)相差较小,但D点溶液体积较大,则c(CH3NH3+)较小,据此分析。
A.B点加入5 mL0.0500 mol/L的稀硫酸,不考虑水解和电离,反应后c(CH3NH3+)=c(CH3NH2),由于pKb(CH3NH2·H2O)=3.4,pKh(CH3NH3+)=14-3.4=10.6,说明CH3NH2H2O的电离程度大于CH3NH3+的水解程度,则溶液中c(CH3NH3+)>c(CH3NH2),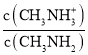 >1,结合Kb(CH3NH2H2O)=
>1,结合Kb(CH3NH2H2O)=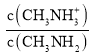 ×c(OH-)=10-3.4可知,c(OH-)<10-3.4,所以B点的pOH>3.4,A正确;
×c(OH-)=10-3.4可知,c(OH-)<10-3.4,所以B点的pOH>3.4,A正确;
B.CH3NH2H2O是一元弱碱,可以部分电离出氢氧根离子,电离过程可逆,则电离方程式为:CH3NH2H2O![]() CH3NH3++OH-,B正确;
CH3NH3++OH-,B正确;
C.用0.0500 mol/L的稀硫酸滴定10 mL 0.1000 mol/L的甲胺溶液滴入10 mL恰好完全反应此时生成的是强酸弱碱盐,溶液显碱性,CH3NH3+水解促进水的电离,A、B点溶液中弱碱过量抑制了水的电离,所以A、B、C三点溶液中,水电离出来的c(H+):C>B>A,C正确;
D.C点硫酸与CH3NH2H2O恰好反应,由于CH3NH3+的水解程度较小,则C、D点n(CH3NH3+)相差较小,但D点加入硫酸溶液体积为C点2倍,则c(CH3NH3+):C>D,D错误;
故合理选项是D。