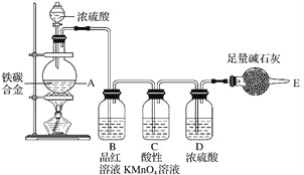
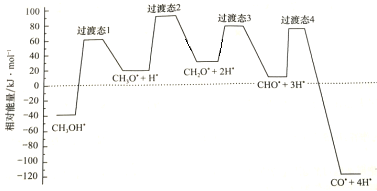
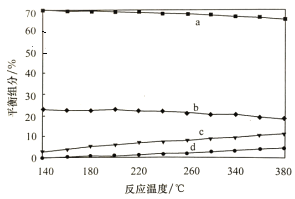
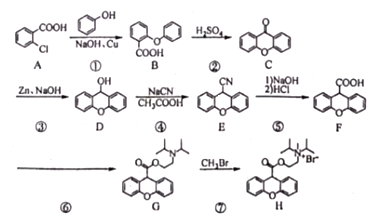
题目内容
【题目】写出以下反应的化学方程式:
(1)Na与水反应:_______
(2)将CO2通入Na2CO3溶液中:_______
(3)将铜粉溶解在浓FeCl3溶液中:_______
(4)向FeCl3溶液中滴加氨水:_______
【答案】2Na + 2H2O=2NaOH + H2↑ Na2CO3 + CO2 + H2O=2NaHCO3 Cu + 2FeCl3=2FeCl2 + CuCl2 FeCl3 + 3NH3·H2O= Fe(OH)3 ↓+ 3NH4Cl
【解析】
(1)Na与水反应:![]() ,故答案为:
,故答案为:![]() ;
;
(2)将CO2通入Na2CO3溶液中:![]() ,故答案为:
,故答案为:![]() ;
;
(3)将铜粉溶解在浓FeCl3溶液中:![]() ,故答案为:
,故答案为:![]() ;
;
(4)向FeCl3溶液中滴加氨水:![]() ,故答案为:
,故答案为:![]() 。
。

练习册系列答案
相关题目
【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
B | C6H12O2 | 能与 NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
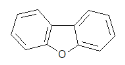
D |
| 该有机物的一氯代物 | 4 |
A.AB.BC.CD.D
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等