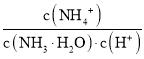题目内容
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g) ![]() CO(g)+2H2(g) △H1=+90.64 kJ/mol
CO(g)+2H2(g) △H1=+90.64 kJ/mol
水蒸气变换反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H2=-41.20 kJ/mol
CO2(g)+H2(g) △H2=-41.20 kJ/mol
则CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H3=____________kJ/mol
CO2(g)+3H2(g) △H3=____________kJ/mol
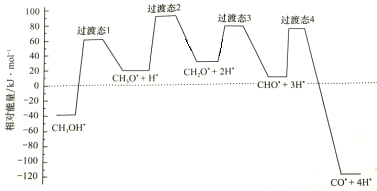
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为________________________________________________。
(3)在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是_____________。
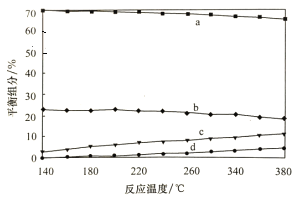
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,a、c曲线对应物质的化学式分别为_______________、______________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____________MPa/h,其平衡常数分压Kp=_________。
【答案】+49.44 CH2O*+2H*=CHO*+3H* (或CH2O*=CHO*+H*) 随着温度升高,催化剂活性降低 H2 H2O ![]() 168.75(MPa)2
168.75(MPa)2
【解析】
(1)甲醇分解反应:CH3OH(g) ![]() CO(g)+2H2(g) △H1=+90.64 kJ/mol ①
CO(g)+2H2(g) △H1=+90.64 kJ/mol ①
水蒸气变换反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H2=-41.20 kJ/mol ②
CO2(g)+H2(g) △H2=-41.20 kJ/mol ②
将①+②,即可求出CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g)的△H3
CO2(g)+3H2(g)的△H3
(2)活化能为反应物的总能量与过渡态能量之差,从图中可以看出,过渡态3发生的反应活化能最小。
(3)①实验测得水煤气变换反应的速率随温度的升高明显下降,若从温度对反应速率的影响考虑,温度升高,则反应速率加快,显然另有原因,只能从催化剂方面寻找原因。
②对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,其他条件不变时,升高温度,平衡向左移动,即CO、H2O的含量均增大,CO2、H2的含量均减小。读图,可初步得知,a、b曲线分别对应CO2或H2,c、d曲线则对应CO或H2O(g)。根据反应方程式可知:该反应起始时,n(H2)>n(CO2)、n(H2O)>n(CO),平衡时含量必然有H2>CO2、H2O>CO。故a、b、c、d曲线分别对应H2、CO2、H2O(g)、CO。
CO2(g)+H2(g) △H<0,其他条件不变时,升高温度,平衡向左移动,即CO、H2O的含量均增大,CO2、H2的含量均减小。读图,可初步得知,a、b曲线分别对应CO2或H2,c、d曲线则对应CO或H2O(g)。根据反应方程式可知:该反应起始时,n(H2)>n(CO2)、n(H2O)>n(CO),平衡时含量必然有H2>CO2、H2O>CO。故a、b、c、d曲线分别对应H2、CO2、H2O(g)、CO。
(4)假设CH3OH的压强变化量为x
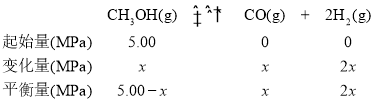
![]() ,x=3.75Mpa,v(CH3OH)=
,x=3.75Mpa,v(CH3OH)=![]() ;Kp=
;Kp=![]() ,代入数据即可求得结果。
,代入数据即可求得结果。
(1)甲醇分解反应:CH3OH(g) ![]() CO(g)+2H2(g) △H1=+90.64 kJ/mol ①
CO(g)+2H2(g) △H1=+90.64 kJ/mol ①
水蒸气变换反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H2=-41.20 kJ/mol ②
CO2(g)+H2(g) △H2=-41.20 kJ/mol ②
将①+②,即可求出CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H3=+90.64 kJ/mol+(-41.20 kJ/mol)=+49.44 kJ/mol。答案为:+49.44;
CO2(g)+3H2(g) △H3=+90.64 kJ/mol+(-41.20 kJ/mol)=+49.44 kJ/mol。答案为:+49.44;
(2) 活化能为反应物的总能量与过渡态能量之差,从图中可以看出,过渡态3发生的反应活化能最小。反应物为“CH2O*+2H*”,产物为“CHO*+3H*,故反应方程式为CH2O*+2H*=CHO*+3H*。因为2H*反应前后都吸附在催化剂表面,未参与反应,故反应实质为CH2O*=CHO*+H*。答案为:CH2O*+2H*=CHO*+3H* (或CH2O*=CHO*+H*);
(3)①因为温度升高,反应速率应加快,而图中速率减小,显然不是温度的影响,只能为催化剂的活性降低。答案为:随温度升高,催化活性降低;
②对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,其他条件不变时,升高温度,平衡向左移动,即CO、H2O的含量均增大,CO2、H2的含量均减小。依据图中信息,可初步得知,a、b曲线分别对应CO2或H2,c、d曲线则对应CO或H2O(g)。根据反应方程式可知:该反应起始时,n(H2)>n(CO2)、n(H2O)>n(CO),平衡时含量必然有H2>CO2、H2O>CO。故a、b、c、d曲线分别对应H2、CO2、H2O(g)、CO。答案为:H2;H2O;
CO2(g)+H2(g) △H<0,其他条件不变时,升高温度,平衡向左移动,即CO、H2O的含量均增大,CO2、H2的含量均减小。依据图中信息,可初步得知,a、b曲线分别对应CO2或H2,c、d曲线则对应CO或H2O(g)。根据反应方程式可知:该反应起始时,n(H2)>n(CO2)、n(H2O)>n(CO),平衡时含量必然有H2>CO2、H2O>CO。故a、b、c、d曲线分别对应H2、CO2、H2O(g)、CO。答案为:H2;H2O;
(4) 假设CH3OH的压强变化量为x
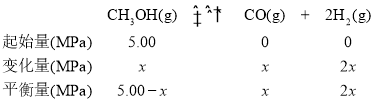
![]() ,x=3.75MPa,v(CH3OH)=
,x=3.75MPa,v(CH3OH)=![]() MPa/t;Kp=
MPa/t;Kp=![]() =168.75(MPa)2。
=168.75(MPa)2。
答案为:![]() ;168.75(MPa)2。
;168.75(MPa)2。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。