题目内容
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ能量,根据能量变化示意图,下列说法不正确的是
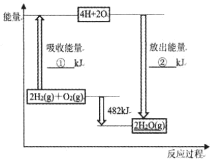
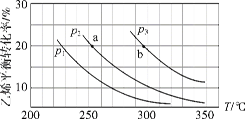
A.①、②的数值分别为1370、1852
B.拆开H2O(g)中的1 molH-O键吸收463kJ的能量
C.2H2(g)+O2(g)=2H2O(g) △H=-482kJ·mol-1
D.已知H2O(1)=H2O(g) △H>0,说明lmolH2O(1)的能量比1molH2O(g)高
【答案】D
【解析】
A.①的数值为2E(H-H)+E(O=O)=2×436+498=1370,②的数值为数值①+482=1370+482=1852,A正确;
B.根据反应热的计算可知:![]()
![]() ,可解得:
,可解得:![]() ,故拆开H2O(g)中的1 molH-O键吸收463kJ的能量,B正确;
,故拆开H2O(g)中的1 molH-O键吸收463kJ的能量,B正确;
C.从图中可以直接得出,2H2(g)+O2(g)=2H2O(g) △H=-482kJ·mol-1,C正确;
D.已知H2O(1)=H2O(g) △H>0,说明该转化是吸热过程,故lmolH2O(1)的能量比1molH2O(g)低,D错误;
故答案为:D。

练习册系列答案
相关题目