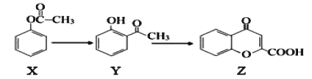
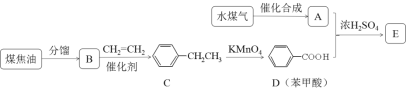
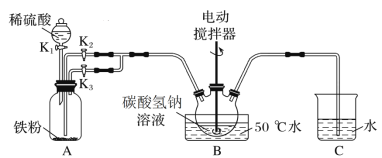
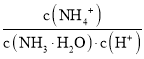题目内容
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
【答案】B
【解析】
反应体系中Fe2O3 (s) 、Fe(s) 为固体,则K= =64,则c(CO2 ):c(CO)=4。
=64,则c(CO2 ):c(CO)=4。
A. 反应达到平衡时,气体的质量则不再增加,而气体的物质的量不变,M=![]() ,则摩尔质量不变,容器中混合气体的平均相对分子质量不变时反应达平衡,与题意不符,A不选;
,则摩尔质量不变,容器中混合气体的平均相对分子质量不变时反应达平衡,与题意不符,A不选;
B. 分析可知,达到平衡状态时,c(CO2 ):c(CO)=4,则乙中CO2的体积分数为80%,符合题意,B选;
C. 甲中n(CO)+ n(CO2)=2,则c(CO2 )=1.6mol/L,体积为1L,则n(CO2 )=1.6mol ,反应的n(CO2)=0.6mol,CO的转化率为60%,与题意不符,C不选;
D. 甲、乙两容器中平衡时,c(CO2 ):c(CO)=4,CO的体积分数均为20%,与题意不符,D不选;
答案为B。

练习册系列答案
相关题目
【题目】甲、乙、丙各取300 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少________?
(2)合金中镁铝的质量分数各是多少________?