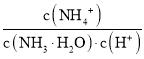题目内容
【题目】某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
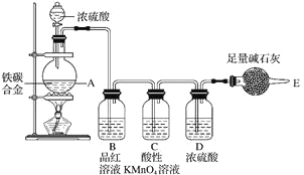
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;
②__。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式__。
(3)B中的现象是__,C的作用是__。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为__(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:__。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)__。
【答案】常温下Fe遇浓硫酸发生钝化 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 品红溶液退色 除去反应产物中的SO2气体
CO2↑+2SO2↑+2H2O 品红溶液退色 除去反应产物中的SO2气体 ![]() 装置内的CO2难以赶尽,导致E质量增重偏小 SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O
装置内的CO2难以赶尽,导致E质量增重偏小 SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O
【解析】
由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数;二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥。
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(3)生成的气体中含有二氧化硫,可使品红溶液褪色;二氧化硫也能被碱石灰吸收,会影响二氧化碳的测定,可以用酸性高锰酸钾溶液吸收;
(4)E增重bg为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为![]() bg,合金中铁的质量为mg-
bg,合金中铁的质量为mg-![]() bg=(m-
bg=(m-![]() b)g,故铁的质量分数
b)g,故铁的质量分数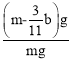 =
=![]() ;
;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大;
(6)由装置图可知,SO2不一定能全部被品红KMnO4除去,E中碱石灰会吸收空气中的CO2、H2O等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
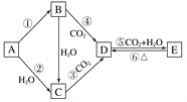
小学生10分钟应用题系列答案【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。