题目内容
15.请按下列要求写出相应粒子的电子排布式,并回答有关问题:(1)写出基态原子或离子的电子排布式:
Fe3+1s22s22p63s23p63d5;Cu1s22s22p63s23p63d104s1.
(2)比较 Fe2+ 与Fe3+的化学稳定性:Fe2+<Fe3+;半径大小:Fe2+>Fe3+(均填“>”或“<”).
分析 (1)根据元素符号,判断微粒的核外电子数,再根据核外电子排布规律来写;
(2)根据二价铁易被氧化生成三价铁比较化学稳定性;根据同种元素核外电子数越多半径越大比较半径大小.
解答 解:(1)Fe元素为26号元素,则Fe3+核外有26-3=23个电子,所以核外电子排布式为:1s22s22p63s23p63d5,Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d5;1s22s22p63s23p63d104s1.
(2)因为二价铁易被氧化生成三价铁,所以化学稳定性:Fe2+<Fe3+;因为同种元素核外电子数越多半径越大,所以半径大小:Fe2+>Fe3+;
故答案为:<;>.
点评 本题考查了基态原子、离子的核外电子排布式以及性质比较,题目难度一般,掌握基础是关键.

练习册系列答案
相关题目
5.常温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
3.下列有关化学用语正确的是( )
| A. | O原子的电子排布图为 | |
| B. | 氯化钠的分子式:NaCl | |
| C. | Cl-的结构示意图: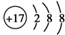 | |
| D. | Ca原子的电子排布式为 1s22s22p63s23p63d2 |
10.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);△H=-akJ•mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是( )
| A. | 4 mo1SO2和2mol O2 | B. | 4mol SO2、2mo1 O2和2mol SO3 | ||
| C. | 4mol SO2和4 mo1 O2 | D. | 6mo1 SO2和4 mo1 O2 |
20.下列实验操作不正确的是( )
| A. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 洗涤沉淀时,应在过滤器中加入洗涤液浸没沉淀,过滤,并重复2到3次 | |
| C. | 抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶支管口倒出 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
7.下列说法正确的是( )
| A. | 分子晶体的熔点比金属晶体的低 | |
| B. | 在晶体中只要有阳离子,一定有阴离子 | |
| C. | 在SiO2晶体中,Si原子与Si-O键数目比为1:2 | |
| D. | 离子化合物中可能含有非极性共价键 |
4.下列各组离子一定能大量共存的是( )
| A. | 在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| C. | 常温下,在pH=12的溶液中:Mg2+、Na+、SO42-、Cl- | |
| D. | 在水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、I-、Cl-、NO3- |