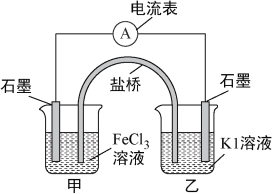
题目内容
【题目】甲、乙两同学,均用惰性电极电解相同浓度的硫酸铜溶液,各通电一段时间后,甲、乙分别向所得的溶液中加入0.1 mol CuO和0.1 mol Cu(OH)2,都恰好使溶液恢复到电解前的浓度。则甲、乙在电解过程中转移的电子的物质的量之比为( )
A.1∶1B.1∶2C.1∶3D.1∶4
【答案】B
【解析】
惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1 mol CuO恰好使溶液恢复到电解前的浓度,说明发生反应2H2O+2CuSO4 ![]() 2Cu+O2↑+2H2SO4;加入0.1molCu(OH)2后恰好恢复到电解前的浓度,说明该电解过程中相当于析出CuO和H2O,说明发生反应2H2O+2CuSO4
2Cu+O2↑+2H2SO4;加入0.1molCu(OH)2后恰好恢复到电解前的浓度,说明该电解过程中相当于析出CuO和H2O,说明发生反应2H2O+2CuSO4 ![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑,据此计算。
2H2↑+O2↑,据此计算。
加入0.1mol CuO后恢复到电解前的浓度,可知发生反应
2H2O+2CuSO4 ![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
故转移电子的总物质的量为0.2mol;
Cu(OH)2从组成上可看成CuOH2O,加入0.1molCu(OH)2后恰好恢复到电解前的浓度,即电解了0.1mol硫酸铜溶液,并电解了0.1mol H2O,由电解的总反应式可知,
2H2O+2CuSO4![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O![]() 2H2↑+O2↑ 转移电子
2H2↑+O2↑ 转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.2mol+0.2mol=0.4mol,则甲、乙在电解过程中转移的电子的物质的量之比为0.2mol:0.4mol=1:2,B项正确;
答案选B。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】常温下,有下列五种溶液:
① | ② | ③ | ④ | ⑤ |
0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______ (填字母)。
A .中和时所需NaOH的量 B .电离程度
C .水电离出的c(H+) D. CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A. B.
B.
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:_______________________________________。
(5)已知CH3COOH的电离平衡常数Ka=1.8×10-5 ,另一种二元弱酸H2B的电离平衡常数为K1=4.3×10- 4 ,K2=5.6×10-1 1 试写出向Na2B溶液中加入过量CH3COOH溶液的化学方程式:_________________________________________。