题目内容
【题目】砷酸![]() 、亚砷酸
、亚砷酸![]() 是两种弱酸。回答下列问题:
是两种弱酸。回答下列问题:
(1)常温下,向![]() 溶液中滴加
溶液中滴加![]() 溶液,混合溶液中由水电离的
溶液,混合溶液中由水电离的![]() 与KOH溶液的体积之间的关系如图所示。
与KOH溶液的体积之间的关系如图所示。

![]() 点对应溶液的pH________
点对应溶液的pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() __________。
__________。
![]() 在一定温度下,向某容器中加入一定量的
在一定温度下,向某容器中加入一定量的![]() 、
、![]() 和NaOH溶液,发生反应:
和NaOH溶液,发生反应:![]() ,
,![]() 的转化率
的转化率![]() 与时间的关系如图所示,测得F点对应溶液中
与时间的关系如图所示,测得F点对应溶液中![]() 、
、![]() ,且溶液
,且溶液![]() 。
。

![]() 点:
点:![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;E点的
;E点的![]() ______G点的
______G点的![]() 。
。
![]() 下列情况表明该反应达到平衡状态的是__________
下列情况表明该反应达到平衡状态的是__________![]() 填字母
填字母![]() 。
。
![]()
![]() 溶液颜色不再变化
溶液颜色不再变化
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]() 溶液中
溶液中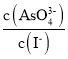 不再变化
不再变化
![]() 在该条件下,上述反应的平衡常数
在该条件下,上述反应的平衡常数![]() ____________
____________![]() 用含m的代数式表示
用含m的代数式表示![]() 。
。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)酸碱抑制水电离,能够水解的盐促进水电离,因此K3AsO4溶液水解显碱性,促进水电离,而KOH与K3AsO4混合溶液显碱性,抑制水电离,结合图像进行分析;
(2)根据图像,结合平衡的建立过程进行分析;根据反应达到平衡状态时,正逆反应速率相等,各组分的浓度保持不变及相关各量进行分析判断;结合三段式求出平衡时各离子浓度,进而计算出平衡常数。
![]() 点KOH溶液过量,则D点对应溶液的
点KOH溶液过量,则D点对应溶液的![]() ,故答案为:
,故答案为:![]() ;
;
![]() 点
点![]() 最大,说明C点恰好完全反应生成
最大,说明C点恰好完全反应生成![]() ,则
,则![]() ,故答案为:10;
,故答案为:10;
![]() 由于从正反应方向建立平衡,则E点:
由于从正反应方向建立平衡,则E点:![]() ;E点的
;E点的![]() 点的
点的![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() ,正逆反应速率不相等,反应没有达到平衡状态,故a不选;
,正逆反应速率不相等,反应没有达到平衡状态,故a不选;
![]() 溶液颜色不再变化,说明
溶液颜色不再变化,说明![]() 的浓度不变,反应达到平衡状态,故b选;
的浓度不变,反应达到平衡状态,故b选;
![]() 溶液的pH不再变化,说明
溶液的pH不再变化,说明![]() 的浓度不变,反应达到平衡状态,故c选;
的浓度不变,反应达到平衡状态,故c选;
![]() 溶液中
溶液中![]() 始终不变,故d不选;
始终不变,故d不选;
故答案为:bc;
![]() 初始时,I-的物质的量浓度为0,平衡时为0.4mol/L,所以变化的
初始时,I-的物质的量浓度为0,平衡时为0.4mol/L,所以变化的![]() 和
和![]() 均为0.2mol/L,平衡时PH=13,所以c(OH-)=0.1mol/L,
均为0.2mol/L,平衡时PH=13,所以c(OH-)=0.1mol/L,![]() 的转化率为m,列出三段式:
的转化率为m,列出三段式:
![]()

反应的平衡常数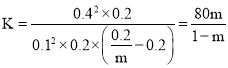 ,故答案为:
,故答案为:![]() 。
。