题目内容
【题目】下列关于化学键及晶体的说法中,正确的是
A.Cl2、Br2、I2的沸点逐渐升高,是因为键能越来越大
B.N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构
C.金属钠的晶体采用简单立方堆积,每个晶胞含1个原子,配位数为6
D.石英晶体和干冰晶体熔沸点不同,是因为所含化学键类型不同
【答案】B
【解析】
A、Cl2、Br2、I2均为分子晶体,且均不存在氢键,分子间只存在分子间作用力,其相对分子质量逐渐增加,故其分子间作用力逐渐增加,其熔点逐渐增加,与键能无关,故A错误;
B、N2中N原子中的最外层电子为5,形成3个共用电子对,所以每个原子的最外层都具有8电子稳定结构, CCl4中每个原子的最外层都具有8电子稳定结构,故B正确;
C、金属钠晶体中钠原子采用体心立方堆积(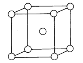 ),每个晶胞中含有原子个数为8×
),每个晶胞中含有原子个数为8×![]() +1=2,每个钠原子周围距离最短且相等的钠原子有8个,其配位数为8,故C错误;
+1=2,每个钠原子周围距离最短且相等的钠原子有8个,其配位数为8,故C错误;
D、石英(SiO2)晶体为原子晶体,晶体内只含有共价键,干冰(CO2)为分子晶体,晶体内只含有共价键,原子晶体融化或蒸发时,晶体内共价键会发生断裂,而分子晶体融化或蒸发时,仅需要克服其分子间作用力,故熔沸点一般原子晶体高于分子晶体,故D错误;
答案为B。

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目



