题目内容
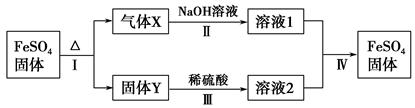
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下: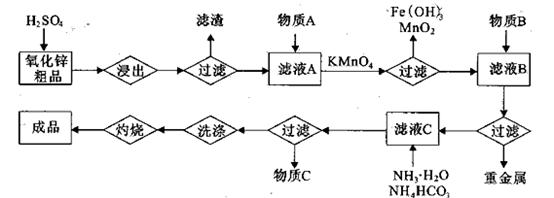
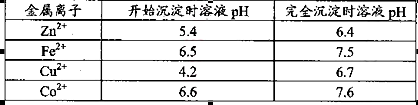
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
该温度下
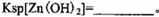 。
。(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中
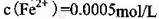 ,则处理1
,则处理1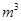 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。(3)杂质Cu2+、
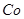 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。(4)被灼烧的沉淀是
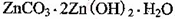 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。如何检验该沉淀是否洗净?________________________________。
(每空2分,共14分)
(1) D ; 1.0×10-20.2
(2)2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ; 26.33
(3)锌粉
(4)3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4;
向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
解析试题分析:(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌 调节溶液的pH值,答案选D;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,所以该温度下Zn(OH)2的Ksp= c(OH-)2×c(Zn2+)=1.0×10-20.2
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为0.5mol/3×158g/mol=26.33g;
(3)杂质Cu2+、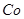 2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3·2Zn(OH)2·H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
考点:考查对流程的分析,溶度积的计算,化学方程式、离子方程式的判断与书写,氧化还原反应的计算,洗涤操作的判断

下列离子或分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是( )
| A.K+、Na+、NO3-、SiO32- | B.Al3+、K+、SO42-、S2- |
| C.Ag+、Na+、NH3·H2O、NO3- | D.Cu2+、Fe2+、Cl-、SO42- |
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能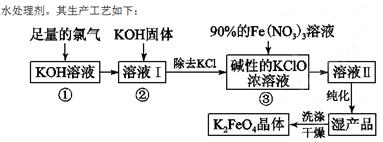
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。 由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取4份100 mL该溶液分别进行如下实验:
| 实验 序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g |
| D | 加少量KMnO4酸性溶液 | KMnO4溶液褪色 |
试回答下列问题:
(1)根据实验a判断Cl-是否存在________(填“一定存在”、“一定不存在”或“不能确定”)。
(2)该混合物中一定不存在的离子是_______________________________。
(3)①写出实验b中发生反应的离子方程式________。
②写出实验d中使KMnO4酸性溶液褪色的离子方程式________________。
(4)溶液中一定存在的阴离子及其物质的量浓度为(可不填满):
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
(5)混合物中是否存在K+?________,判断的理由是__________________。


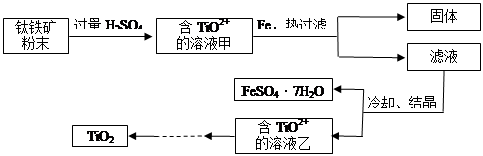
 TiCl4
TiCl4 Ti
Ti