题目内容
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为_________
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:__________
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_______________
(1)HCN H++CN-,>;(2)[Au(CN)2]+
H++CN-,>;(2)[Au(CN)2]+ [Au(CN)] 2++CN-;
[Au(CN)] 2++CN-;
(3)5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
(4)在酸性条件下CN-与H+结合生成毒性很强的HCN,对人体造成危害。
解析试题分析:(1)HCN是弱酸,在溶液中存在电离平衡,其电离方程式为HCN H++CN-;(2) [Au(CN)2]+存在着两步电离,其一级电离方程式为[Au(CN)2]+
H++CN-;(2) [Au(CN)2]+存在着两步电离,其一级电离方程式为[Au(CN)2]+ [Au(CN)] 2++CN-;(3)处理含有络离子[Au(CN)2]+废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,根据离子方程式的书写原则,该反应的离子方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行是因为在酸性条件下CN-与H+结合生成毒性很强的HCN,对人体造成更大的危害。
[Au(CN)] 2++CN-;(3)处理含有络离子[Au(CN)2]+废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,根据离子方程式的书写原则,该反应的离子方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行是因为在酸性条件下CN-与H+结合生成毒性很强的HCN,对人体造成更大的危害。
考点:考查炼金废水的治理、离子方程式的书写、弱电解质的电离方程式的书写的知识。

下列离子在溶液中能大量共存的一组是
| A.Fe3+、H+、ClO-、SO32- | B.K+、Al3+、Cl-、CO32- |
| C.Na+、Ca2+、HCO3-、OH- | D.Al3+、NH4+、Cl-、SO42- |
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下: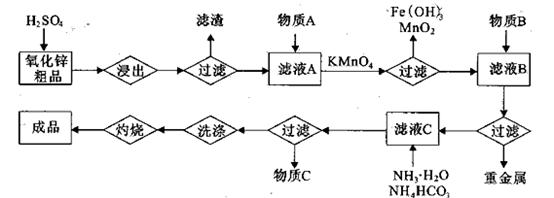
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、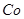 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
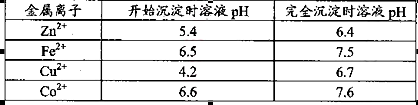
该温度下
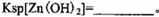 。
。(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中
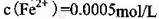 ,则处理1
,则处理1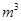 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。(3)杂质Cu2+、
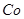 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。(4)被灼烧的沉淀是
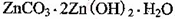 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。如何检验该沉淀是否洗净?________________________________。
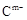 、
、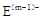 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:

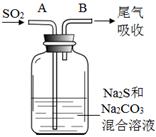
 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。