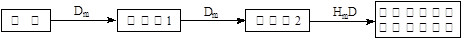题目内容
(16分)石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为 。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为kg 。
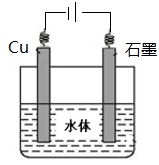
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。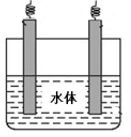
(1)排除空气,减少C的损失;
(2)SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O;
(3)过滤;Cl-、OH-、AlO2?;
(4)CH3COOCH2CH3+AlO2?+ 2H2O  Al(OH)3↓+CH3COO-+ CH3 CH2OH;78
Al(OH)3↓+CH3COO-+ CH3 CH2OH;78
(5)
解析试题分析:(1)石墨的化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入N2目的是作保护气,排除空气中的氧气,减少C的损失;
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。根据杂质的含量,气体I中的氯化物主要SiCl4、AlCl3、FeCl3;SiCl4的沸点是57.6ºC,所以气体II为SiCl4,与氢氧化钠溶液反应生成硅酸钠和氯化钠,化学方程式为SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O;
(3)金属氯化物的沸点均高于150ºC,所以固体III中存在氯化铝、氯化铁、氯化镁,其中氯化铁、氯化镁与过量氢氧化钠溶液反应生成沉淀,而氯化铝与过量氢氧化钠溶液反应生成偏铝酸钠,所以搅拌后过滤,所得溶液IV中阴离子有Cl-、OH-、AlO2?;
(4)偏铝酸钠发生水解反应,加入乙酸乙酯的目的是除去过量的氢氧化钠且加热条件下水解平衡一直正向移动,生成沉淀氢氧化铝,总离子方程式为 CH3COOCH2CH3+AlO2?+ 2H2O Al(OH)3↓+CH3COO-+ CH3 CH2OH;1000kg石墨中含有Al2O351kg,根据元素守恒,可得到Al(OH)3的质量是78kg。
CH3COOCH2CH3+AlO2?+ 2H2O Al(OH)3↓+CH3COO-+ CH3 CH2OH;1000kg石墨中含有Al2O351kg,根据元素守恒,可得到Al(OH)3的质量是78kg。
(5)铜的化学性质比石墨活泼,所以应用外加电流的阴极保护法保护铜,所以石墨作阳极,铜作阴极。在图中注明电源的正负极,石墨与正极相连,铜与负极相连。
考点:考查物质的制备分析,对题目所给信息的理解应用,化学方程式、离子方程式的判断与书写,简单计算,电化学防护的应用

下列各组离子能大量共存的是
| A.NaClO水溶液中:Fe2+、Cl-、Ca2+、H+ |
| B.加入KSCN显红色的溶液:K+、Na+、I-、S2- |
| C.无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4- |
| D.pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
下列离子方程式的书写正确的是( )
| A.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑ |
| B.NaHCO3溶液与NaOH溶液反应: OH― + HCO3―= CO32― + H2O |
| C.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O |
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。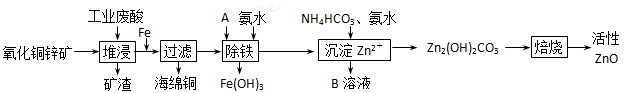
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。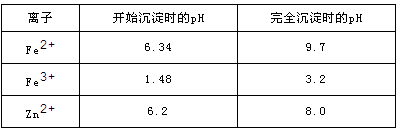
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下: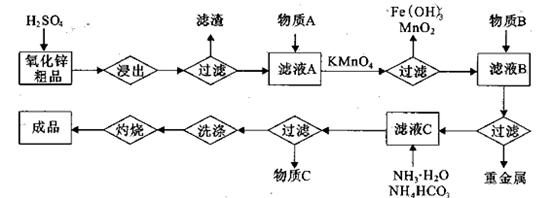
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |

该温度下
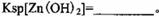 。
。(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中
 ,则处理1
,则处理1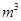 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。(3)杂质Cu2+、
 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。(4)被灼烧的沉淀是
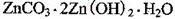 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。如何检验该沉淀是否洗净?________________________________。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、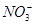 、
、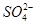 、Cl-、I-、
、Cl-、I-、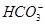 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
(1)溶液中一定存在的离子是 ;溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤) 。
(3)写出实验⑤中所有反应的离子方程式: 。
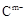 、
、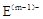 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题: