题目内容
14.写出氮分子的电子式 .
.
分析 氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键.
解答 解:氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为 ,故答案为:
,故答案为: .
.
点评 本题主要考查了氮气的电子式的书写,属于基础知识,难度不大,注意基础知识的积累.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
4.下列关于F、Cl、Br、I的比较,说法正确的是( )
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质的氧化性随核电荷数的增加而增强 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而增强 |
5.湖南大米镉超标为食品安全再次敲响警钟.镉有多种核素,在自然界含量较多的两种核素是${\;}_{48}^{114}$Cd、${\;}_{48}^{112}$Cd,下列说法正确的是( )
| A. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd互称同位素 | |
| B. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd的原子核内中子数相等 | |
| C. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd的质量数相等 | |
| D. | ${\;}_{48}^{114}$Cd与${\;}_{48}^{112}$Cd含有不同的电子数 |
9.下列气体在水中溶解度最大的是( )
| A. | NO | B. | SO2 | C. | CO2 | D. | Cl2 |
19.将等物质的量的X2和Y2置于一密闭容器中,在一定条件下反应:mX2(g)+2Y2(g)?pZ(g),达到平衡时测得容器中c(X2)=0.1mol/L,c(Y2)=0.9mol/L,c(Z)=0.8mol/L,则Z的化学式可能是( )
| A. | X2Y3 | B. | XY3 | C. | X2Y4 | D. | X3Y |
6.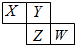 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
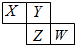 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 4种元素的单质中,Z单质的熔、沸点最高 | |
| D. | W单质能与水反应,生成一种具有漂白性的物质 |
3.下列各组物质中,互为同素异形体的是( )
| A. | 红磷与白磷 | B. | 甲烷与乙烷 | C. | ${\;}_{1}^{1}$H与${\;}_{1}^{2}$H | D. | 正丁烷与异丁烷 |
4.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2═□+2FeS+SO2,下列说法不正确的是( )
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |