题目内容
19.将等物质的量的X2和Y2置于一密闭容器中,在一定条件下反应:mX2(g)+2Y2(g)?pZ(g),达到平衡时测得容器中c(X2)=0.1mol/L,c(Y2)=0.9mol/L,c(Z)=0.8mol/L,则Z的化学式可能是( )| A. | X2Y3 | B. | XY3 | C. | X2Y4 | D. | X3Y |
分析 依据化学平衡三段式列式计算,mX2(g)+2Y2(g)═pZ(g),变化量之比等于化学计量数之比,然后利用质量守恒定律可得出Z的化学式.
解答 解:mX2(g)+2Y2(g)═pZ(g),
起始量(mol•L-1) a a 0
变化量(mol•L-1) a-0.1 a-0.9 0.8
平衡量(mol•L-1) 0.1 0.9 0.8
根据变化量之比等于化学计量数之比,$\frac{a-0.1}{a-0.9}$=$\frac{m}{2}$,讨论可知,m=6,a=1.3,则p=4,
化学方程式为6X2(g)+2Y2(g)═4Z(g),
根据质量守恒定律可知,反应前后的原子个数相等,所以Z的化学式为X3Y,
故选D.
点评 本题考查化学平衡三段式列式计算方法,明确变化量之比等于化学计量数之比及质量守恒定律是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
9.在由Fe3O4和 Fe组成的6.88g固体混合物中加入稀硫酸,当加入50mL 2mol/LH2SO4时,恰好使固体完全溶解,并放出一定量气体.在所得溶液中加入KSCN溶液,溶液不变红色.则下列说法正确的是( )
| A. | 混合物中Fe的物质的量为0.03mol | |
| B. | 混合物中Fe3O4的物质的量为0.01mol | |
| C. | 反应中产生的气体在标准状况下的体积为448mL | |
| D. | 若用足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到7.2g铁 |
10.“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应不符合“绿色化学”理念的是( )
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH$\stackrel{Pd}{→}$CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
7.可逆反应2SO2(g)+O2(g)?2SO3(g)在恒容密闭容器中达到平衡,下列说法正确的是( )
| A. | SO2和O2不再化合,反应停止了 | |
| B. | 容器内压强保持不变 | |
| C. | SO2、O2和 SO3的浓度相等 | |
| D. | SO2、O2和 SO3的物质的量之比为2:1:2 |
4.现有7瓶失去标签的液体,已知它们是有机试剂,可能是:①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液,现通过如下实验来确定各试剂瓶中所装的液体:
试给它们的试剂瓶重新贴上标签,其中:
A乙醇,C苯,E油脂,F葡萄糖,G蔗糖溶液.
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A?B?C?D?E?F?G后,闻气味 | 只有F?G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C?E?D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C?E?D于试管中,加稀NaOH 溶液并加热 | 只有C仍有分层现象,且在D的试管中闻 到特殊香味 |
A乙醇,C苯,E油脂,F葡萄糖,G蔗糖溶液.
11.丙烯酸的结构简式为CH2=CH-COOH,下列说法不正确的是( )
| A. | 与钠反应放出氢气 | B. | 能与新制的Cu(OH)2悬浊液反应 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 能发生加聚反应生成高分子化合物 |
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L己烷中的分子数约为NA个 | |
| B. | 常温常压下,在18 g H218O中含有NA个水分子 | |
| C. | 标准状况下,15 g CH3CH3所含共价键数为3.5NA个 | |
| D. | 电解精炼铜时,若电路中转移的电子数为2NA个,则阳极质量减轻64 g |
9.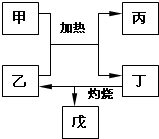 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表
用化学用语答下列问题:
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为
(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为

(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
 .
.