题目内容
4.下列关于F、Cl、Br、I的比较,说法正确的是( )| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质的氧化性随核电荷数的增加而增强 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而增强 |
分析 A.同一主族元素最外层电子数相等;
B.元素的非金属性越强,其单质的氧化性越强;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.同一主族元素,元素的非金属性随着核电荷数增大而减弱.
解答 解:A.同一主族元素最外层电子数相等,卤族各元素最外层电子数相等,都是7,故A错误;
B.元素的非金属性越强,其单质的氧化性越强,非金属性强弱F>Cl>Br>I,所以卤素单质的氧化性随核电荷数的增加而减弱,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性强弱F>Cl>Br>I,所以氢化物的稳定性HF>HCl>HBr>HI,故C正确;
D.同一主族元素,随着原子核电荷数的增大,原子核对最外层电子吸引力逐渐减小,所以元素的非金属性随着核电荷数的增大而减弱,故D错误;
故选C.
点评 本题考查同一主族元素周期律,明确原子结构和元素性质关系是解本题关键,熟练掌握碱金属族、卤族中同一主族原子结构和元素性质递变规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列各组中两个变化所发生的反应,属于同一类型的是( )
| A. | 乙烯使溴水褪色、乙酸乙酯在加热的条件下使含酚酞的NaOH溶液颜色变浅 | |
| B. | 由氯乙烯制聚氯乙烯、由纤维素制硝酸纤维 | |
| C. | 由油脂制甘油、由蛋白质制氨基酸 | |
| D. | 由甲苯制甲基环己烷、由乙烷制溴乙烷 |
12.下列事实不能说明氯元素非金属性比硫元素强的是( )
| A. | Cl2通入Na2S溶液中,能产生淡黄色沉淀 | |
| B. | HCl的热稳定性比H2S强 | |
| C. | HClO4的酸性比H2SO4强 | |
| D. | HCl的酸性比H2S强 |
9.在由Fe3O4和 Fe组成的6.88g固体混合物中加入稀硫酸,当加入50mL 2mol/LH2SO4时,恰好使固体完全溶解,并放出一定量气体.在所得溶液中加入KSCN溶液,溶液不变红色.则下列说法正确的是( )
| A. | 混合物中Fe的物质的量为0.03mol | |
| B. | 混合物中Fe3O4的物质的量为0.01mol | |
| C. | 反应中产生的气体在标准状况下的体积为448mL | |
| D. | 若用足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到7.2g铁 |
16.据最新报道:我国限塑3年,少用240亿个塑料袋.下列有关说法错误的是( )
| A. | 限塑的主要意义是减少白色污染 | |
| B. | 塑料袋的材料主要是聚乙烯、聚氯乙烯等 | |
| C. | 聚乙烯、聚氯乙烯等塑料都是天然高分子材料 | |
| D. | 聚乙烯是由乙烯分子通过加成反应聚合而成 |
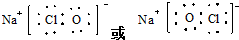 .
. (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.



 .
.