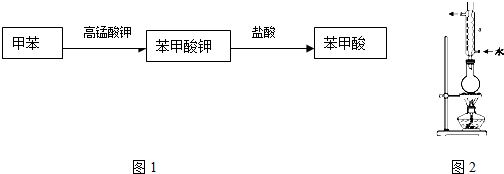
题目内容
14.NiSO4.6H2O是一种绿色易容于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图1:(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有容量瓶、胶状滴管.
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:Cu2++S2-═CuS↓.
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬.此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.图2是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是cd(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是NiSO4.
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是上层清液呈无色.
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol•L-1的H2SO4溶液,蒸馏水、pH试纸】.
①过滤,并用蒸馏水洗涤沉淀2~3次,直至流出的溶液用pH试纸检验呈中性;
②向沉淀中加6 mol•L-1的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.

分析 废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去铁离子,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,滤液I中加入硫化钠形成CuS、ZnS沉淀,可除去铜离子、锌离子,过滤,滤液II中加H2O2是将二价铁氧化成三价铁,再通过调节pH使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,主要是NiSO4,还有Na2SO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)配制一定浓度的稀硫酸用到的玻璃仪器有烧杯、量筒、玻璃棒、容量瓶、胶状滴管;
(2)加Na2S,易生成CuS沉淀;
(3)a.根据化合价的代数和为零分析;
b.pH=4,c(OH-)=1×10-10 mol•L-1,根据Ksp计算铁离子的浓度;
c.用氯酸钠在酸性条件下氧化Fe2+生成铁离子和氯离子;
d.根据图象判断生成黄铁矾钠的条件;
(4)根据流程分析判断;
(5)含有Ni2+的溶液显绿色;
(6)向含有NiSO4溶液中加碳酸钠,得到NiCO3沉淀,过滤、洗涤,向沉淀中加硫酸溶解,得到NiSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得NiSO4•6H2O晶体;
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去铁离子,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,滤液I中加入硫化钠形成CuS、ZnS沉淀,可除去铜离子、锌离子,过滤,滤液II中加H2O2是将二价铁氧化成三价铁,再通过调节pH使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,主要是NiSO4,还有Na2SO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)配制一定浓度的稀硫酸用到的玻璃仪器有烧杯、量筒、玻璃棒、容量瓶、胶状滴管;
故答案为:容量瓶、胶状滴管;
(2)加Na2S,易生成CuS沉淀,其反应的离子方程式为:Cu2++S2-═CuS↓;
故答案为:Cu2++S2-═CuS↓;
(3)a.FeOOH中O为-2价,H为+1价,则铁为+3价,故a错误;
b.pH=4,c(OH-)=1×10-10 mol•L-1,Ksp=c(Fe3+)×c3(OH-),则c(Fe3+)=$\frac{Ksp}{c{\;}^{3}(OH{\;}^{-})}$=$\frac{2.64×1{0}^{-39}}{(10{\;}^{-10}){\;}^{3}}$=2.64×10-9 mol/L,故b错误;
c.用氯酸钠在酸性条件下氧化Fe2+生成铁离子和氯离子,其反应的离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,故c正确;
d.由图象判断可知生成黄铁矾钠的条件为:温度为85~95℃,水体的pH为1.2~1.8,故d正确;
故答案为:cd;
(4)由流程分析可知滤液Ⅲ的主要成分是NiSO4;
故答案为:NiSO4;
(5)含有Ni2+的溶液显绿色,当溶液由绿色变为无色,说明镍离子已经完全沉淀;
故答案为:上层清液呈无色;
(6)向含有NiSO4溶液中加碳酸钠,得到NiCO3沉淀,过滤、洗涤,向沉淀中加硫酸溶解,得到NiSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得NiSO4•6H2O晶体,则从溶液中提取硫酸镍的步骤为:
①过滤,并用蒸馏水洗涤沉淀2~3次,直至流出的溶液用pH试纸检验呈中性;
②向沉淀中加6 mol•L-1的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.
故答案为:过滤,并用蒸馏水洗涤沉淀2~3次,直至流出的溶液用pH试纸检验呈中性;向沉淀中加6 mol•L-1的H2SO4溶液,直至恰好完全溶解;蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体.
点评 本题考查物质的分离提纯的实验方案的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.

| A. |  | B. |  | C. |  | D. |  |

溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(2)过滤所需的玻璃仪器有玻璃棒、漏斗,烧杯.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤(或乙醇洗涤)、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案.①取少量的氢溴酸粗产生与试管中,滴加少量植物油,将长滴管插入液面下滴加淀粉KI溶液变为蓝色,说明含有Br2,否则不含有Br2;
②另取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-,否则不含SO42-限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油.
| A. | 酒精、冰醋酸分别属于电解质、弱电解质 | |
| B. | 冶炼金属钠、铁,工业常用的方法分别是电解法、热分解法 | |
| C. | 铝热反应、实验室制氢气都属于置换反应 | |
| D. | 冰醋酸、碱式碳酸铜分别属于:酸、碱 |
 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑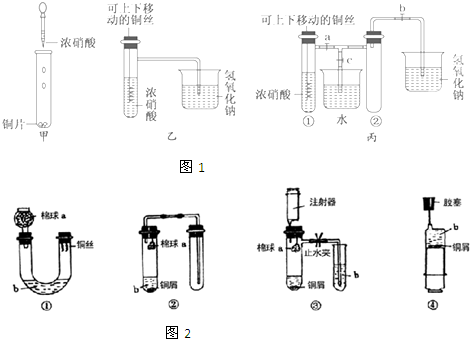
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: