题目内容
4.下列判断正确的是( )| A. | 酒精、冰醋酸分别属于电解质、弱电解质 | |
| B. | 冶炼金属钠、铁,工业常用的方法分别是电解法、热分解法 | |
| C. | 铝热反应、实验室制氢气都属于置换反应 | |
| D. | 冰醋酸、碱式碳酸铜分别属于:酸、碱 |
分析 A、弱电解质是在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐,电解质是指在水溶液或是熔融状态下能导电的化合物;
B、金属的冶炼一般有电解法、热还原法、热分解法、物理分离法,根据金属的活泼性确定金属的冶炼方法;
C、置换反应是单质和化合物之间反应生成新单质和新化合物的反应;
D、酸是指电离出的阳离子全部是氢离子的化合物,碱是指电离出的阴离子全部是氢氧根离子的化合物.
解答 解:A、酒精、冰醋酸分别属于非电解质、弱电解质,故A错误;
B、冶炼金属钠、铁,工业常用的方法分别是电解法、热还原法,故B错误;
C、铝热反应是金属铝和氧化铁之间的反应,产生金属铁和氧化铝,实验室制氢气的反应是碳和水之间的反应,产物是一氧化碳和氢气,二者都属于置换反应,故C正确;
D、冰醋酸、碱式碳酸铜分别属于:酸、盐,故D错误.
故选C.
点评 本题考查学生物质得分类知识,注意概念的理解和应用是解题的关键,难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
9.已知NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.2NA | |
| B. | 1.2gNaHSO4固体中含有的阳离子数目为0.02NA | |
| C. | Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.2NA | |
| D. | 4.6 g NO2和N2O4混合物中含有的原子总数为0.3NA |
13.有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是( )
| A. | 若B(OH)m 是强碱,则A(OH)m一定为强碱 | |
| B. | 若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 | |
| C. | 若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属 | |
| D. | 若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性 |
14.某烃的分子量为84,可使酸性高锰酸钾溶液褪色,该烃的链状且主链上有4个碳原子的同分异构体的数目是( )(不考虑顺反异构)
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |

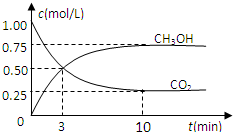 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.