题目内容
9.某化学实验小组的同学对铜与硝酸反应的实验及铜的制备、回收利用进行了下列几方面的研究: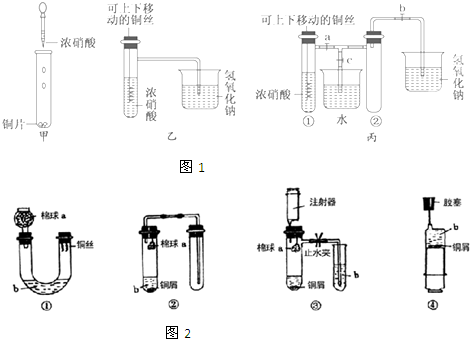
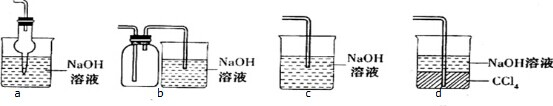
(1)图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
甲、乙、丙三个装置中共同发生的离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)和甲装置相比,乙装置的优点是①可以控制反应;②吸收NO2气体,防止污染环境.
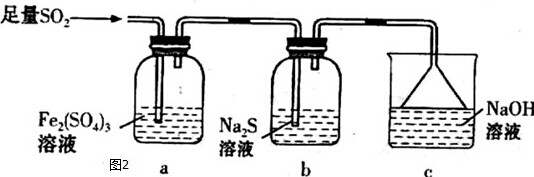
(3)做铜与浓硝酸反应的实验时,为了减少污染,化学实验小组的又同学设计了以下四种装置,希望在不拆除、不增加仪器的情况下既能观察到反应现象,又能使二氧化氮被吸收(氢氧化钠可吸收).设计的装置(如图2)能达目的是:①③(填序号).
(4)在做铜与稀硝酸反应的实验时,常看到生成的气体为浅红棕色,其原因是:试管内有空气存在,将生成的NO氧化为NO2,2NO+O2=2NO2;为了能直接观察到生成气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐即可达到目的,那么加入碳酸盐的作用是:碳酸盐与硝酸的反应速率快,生成的CO2排走了试管内的空气.
Ⅱ(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被还原 (填“氧化”还是“还原”)成铜单质.
(2)可用FeCl3溶液浸泡印刷电路板上的铜制备CuCl2•2H2O,实验室模拟回收过程如下:
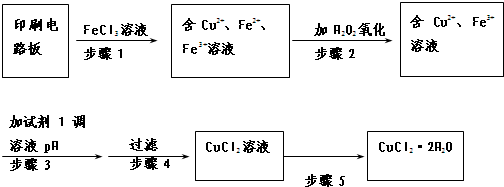
①步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为 4×10-11 mol/L[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是CuO或Cu(OH)2(写出一种即可).
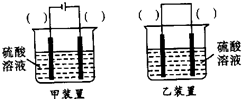
②欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).
分析 Ⅰ、(1)铜与浓硝酸的反应生成二氧化氮和硝酸铜;
(2)根据甲乙两个装置的不同点分析;
(3)对4个装置逐一分析,并考虑实验中应该如何操作.对于装置①应将U形管向右偏转,让浓硝酸与螺旋状钢丝接触,产生NO2气体后再扶正U形管,使铜丝与硝酸脱离接触,反应终止;对于装置③应该先关闭止水夹,产生的NO2气体进入注射器后再打开止水夹,同时还应该考虑到b试管中应该盛装的是氢氧化钠溶液,才能与产生的NO2气体反应;
(4)铜和稀硝酸 反应生成硝酸铜、一氧化氮和水;观察到试管内生成的气体先为浅红棕色是因为试管中含有空气,一氧化氮被氧气氧化为红棕色气体二氧化氮;加入碳酸盐会和硝酸反应生成二氧化碳气体把试管中空气赶净,便于观察生成的无色一氧化氮气体;
Ⅱ、(1)元素化合价降低被还原,铜元素化合价降低为0价;
(2)①根据pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质;
②Cu和H2SO4之间的反应是非自发的,需要电解池实现,根据电解池的构成条件来回答.
解答 解:Ⅰ、(1)甲、乙、丙三个装置中共同的一个反应是浓硝酸与铜片反应或是浓硝酸与铜丝反应,即Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)甲、乙两个装置的差异在于:甲装置铜与浓硝酸反应使用的是铜片直接与浓硝酸反应,而乙装置则是可移动的铜丝与浓硝酸反应,其优点为便于控制,需要时插入酸液就反应,不需要时从酸液中移出即可;甲装置没有处理NO2污染的装置,而乙装置用氢氧化钠溶液吸收产生的NO2,能防止空气污染.
故答案为:①可以控制反应;②吸收NO2气体,防止污染环境;
(3)对4个装置逐一分析,并考虑实验中应该如何操作.对于装置①应将U形管向右偏转,让浓硝酸与螺旋状钢丝接触,产生NO2气体后再扶正U形管,使铜丝与硝酸脱离接触,反应终止;对于装置③应该先关闭止水夹,产生的NO2气体进入注射器后再打开止水夹,同时还应该考虑到b试管中应该盛装的是氢氧化钠溶液,才能与产生的NO2气体反应,设计的装置(如图2)能达目的是①、③,
故答案为:①③;
(4)铜和稀硝酸 反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;观察到试管内生成的气体先为浅红棕色是因为试管中含有空气,一氧化氮被氧气氧化为红棕色气体二氧化氮,2NO+O2=2NO2;加入碳酸盐会和硝酸反应生成二氧化碳气体把试管中空气赶净,便于观察生成的无色一氧化氮气体;
故答案为:2NO+O2=2NO2; 碳酸盐与硝酸的反应速率快,生成的CO2排走了试管内的空气;
Ⅱ、(1)火法炼铜:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,湿法炼铜:CuSO4+Fe═FeSO4+Cu,铜元素化合价从+1、+2价反应后变化为0价,铜元素的化合价降低,Cu2S、CuSO4都为氧化剂,被还原,发生还原反应,
故答案为:还原;
(2)①pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质,可向溶液中加入CuO或Cu(OH)2,故答案为:CuO或Cu(OH)2;
②Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即 ,故答案
,故答案 .
.
点评 本题把实验知识与浓硝酸的性质、二氧化氮的性质、喷泉实验的发生等结合一起,具有很强的综合性,因而难度较大,需要细心审题,认真分析,侧重于考查学生的实验能力和对基础知识的综合应用能力.

 小学课时特训系列答案
小学课时特训系列答案(1)已知:H-H键能为436KJ•mol-1,N≡N键能为945KJ•mol-1,N-H键能为391KJ•mol-1.写出合成氨反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1
(2)可逆反应N2+3H2?2NH3在恒容密闭容器中进行,达到平衡状态的标志是②⑤
①单位时间内生成n mo1N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(4)氨是氮肥工业的重要原料.某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:

请写出制备(NH4)2SO4的反应方程式:CaSO4+(NH4)2CO3=(NH4)2SO4+CaCO3↓;并利用有关数据简述上述反应能发生的原因因为Ksp(CaSO4)=7.10×10-5>Ksp(CaCO3)=4.96×10-9.