题目内容
3.在2升容器中加入18g水蒸气,28g一氧化碳,在t℃时(t>100),发生如下反应:CO+H2O?CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02mol•l-1•s-1求:(1)5秒钟末,容器内CO2和H2O蒸汽浓度分别为0.1mol/L,0.4mol/L.
(2)若设计此反应为一个原电池,则负极发生氧化反应(填“氧化”,“还原”),负极消耗的物质化学式为CO.
分析 (1)根据△c=v×△计算△c(CO),浓度变化量之比等于化学计量数之比,据此计算△c(CO2)、△c(H2O),5秒末水的浓度=水的起始浓度-△c(H2O);
(2)原电池负极发生氧化反应.
解答 解:(1)△c(CO)=0.02mol•l-1•s-1×5s=0.1mol/L,浓度变化量之比等于化学计量数之比,则△c(CO2)=△c(H2O)=△c(CO)=0.1mol/L,5秒末水的浓度=$\frac{\frac{18g}{18g/mol}}{2L}$-0.1mol/L=0.4mol/L,
故答案为:0.1mol/L;0.4mol/L;
(2)原电池负极发生氧化反应,反应中CO发生氧化反应,负极消耗的物质为CO,
故答案为:氧化;CO.
点评 本题考查化学平衡计算、反应速率计算、原电池,比较基础,注意对速率规律的理解掌握.

练习册系列答案
相关题目
11.将 4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经 2s(秒)后测得 C 的浓度为 0.6mol•L-1,现有下列正确的是( )
| A. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 2 s 时物质 B 的浓度为 0.7 mol•L-1 | |
| C. | 2 s 时物质 A 的转化率为70% | |
| D. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 |
18.(1)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436KJ•mol-1,N≡N键能为945KJ•mol-1,N-H键能为391KJ•mol-1.写出合成氨反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1
(2)可逆反应N2+3H2?2NH3在恒容密闭容器中进行,达到平衡状态的标志是②⑤
①单位时间内生成n mo1N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
5min内,消耗N2的平均反应速率为0.008mol/(L.min);此条件下该反应的化学平衡常数K=0.1;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向逆反应(填“正反应”或“逆反应”)方向移动.
(4)氨是氮肥工业的重要原料.某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:
请写出制备(NH4)2SO4的反应方程式:CaSO4+(NH4)2CO3=(NH4)2SO4+CaCO3↓;并利用有关数据简述上述反应能发生的原因因为Ksp(CaSO4)=7.10×10-5>Ksp(CaCO3)=4.96×10-9.
(1)已知:H-H键能为436KJ•mol-1,N≡N键能为945KJ•mol-1,N-H键能为391KJ•mol-1.写出合成氨反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1
(2)可逆反应N2+3H2?2NH3在恒容密闭容器中进行,达到平衡状态的标志是②⑤
①单位时间内生成n mo1N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(4)氨是氮肥工业的重要原料.某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:

请写出制备(NH4)2SO4的反应方程式:CaSO4+(NH4)2CO3=(NH4)2SO4+CaCO3↓;并利用有关数据简述上述反应能发生的原因因为Ksp(CaSO4)=7.10×10-5>Ksp(CaCO3)=4.96×10-9.
13.有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是( )
| A. | 若B(OH)m 是强碱,则A(OH)m一定为强碱 | |
| B. | 若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 | |
| C. | 若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属 | |
| D. | 若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性 |
 Cu(OH)2·CuCl2+2HCl↑+2H2O↑。则下列有关叙述中错误的是( )
Cu(OH)2·CuCl2+2HCl↑+2H2O↑。则下列有关叙述中错误的是( )
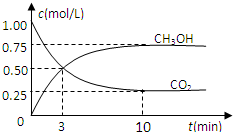 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中(体积不变),充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.