题目内容
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )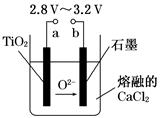
| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
C
解析

 名校课堂系列答案
名校课堂系列答案某小组为研究原电池原理,设计如图装置,下列叙述正确的是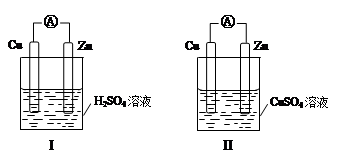
| A.装置I,铜片上有O2逸出 |
| B.装置I,锌片溶解,发生还原反应 |
| C.装置II,电池反应为:Zn+ Cu2+= Zn2++ Cu |
| D.装置II,外电路中,电子从锌电极流向铜电极 |
关于如图所示各装置的叙述中,正确的是
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是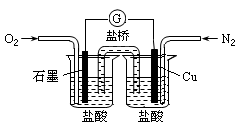
| A.此装置能将化学能转变为电能 |
| B.石墨电极的反应式:O2+2H2O+4e—=4OH— |
| C.电子由Cu电极经导线流向石墨电极 |
| D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O |
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。目前固体电解质在制造全固态电池及其他传感器、探测器等方面的应用日益广泛。如RbAg4I5晶体,其中迁移的物种全是Ag+,室温导电率达0.27 Ω-1·cm-1。利用RbAg4I5晶体,可以制成电化学气敏传感器。下图是一种测定O2含量的气体传感器示意图,被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是 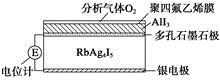
| A.I2+2Rb++2e-=2RbI | B.I2+2Ag++2e-=2AgI |
| C.Ag-e-=Ag+ | D.4AlI3+3O2=2Al2O3+6I2 |
[双选题]烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的
CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )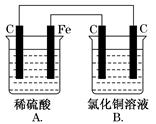
| A.A为原电池,B为电解池 |
| B.A为电解池,B为原电池 |
| C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol |
| D.一段时间后,B烧杯中溶液的浓度增大 |
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+ Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属铜为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
电解100 mL含c(H+)=0.30 mol·L-1下列溶液,当电路中通过0.04 mol
电子时,理论上析出金属质量最大的是( )
| A.0.10 mol·L-1AgNO3溶液 |
| B.0.10 mol·L-1ZnSO4溶液 |
| C.0.20 mol·L-1CuCl2溶液 |
| D.0.20 mol·L-1Pb(NO3)2溶液 |