题目内容
关于如图所示各装置的叙述中,正确的是
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
C
解析试题分析:A、装置①是原电池,Fe比Cu活泼,所以Fe与Fe3+反应生成Fe2+,错误;B、装置①中,铁作负极,发生氧化反应,Fe-2 e-= Fe2+,错误;C、氢氧化铁胶体粒子带正电荷,所以氢氧化铁胶体粒子向阴极移动,装置②中石墨Ⅱ作阴极,因此石墨Ⅱ电极附近溶液红褐色加深,正确;D、由电流方向判断c是阳极,d是阴极,电解精炼铜时粗铜作阳极,所以c为粗铜,d为纯铜,错误,答案选C。
考点:考查电化学理论的应用

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含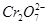 的工业废水的处理。下列说法正确的是
的工业废水的处理。下列说法正确的是
A.图乙中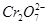 向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 |
| B.图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 |
| C.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ |
| D.若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀 |
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是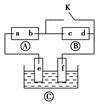
| A.b为直流电源的负极 |
| B.f极为阴极,发生还原反应 |
| C.e极材料为铁片,f极材料为铜片 |
| D.可选用CuSO4溶液或CuCl2溶液作电镀液 |
肼(N2H4)——空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+ O2=N2+2H2O。下列关于该电池工作时说法中正确的是
| A.溶液的pH保持不变 |
| B.溶液中的阴离子向正极移动 |
| C.正极的电极反应式:O2+4H++4e—=2H2O |
| D.负极的电极反应式:N2H4+4OH—﹣4e— =4H2O +N2 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
| C.电池反应的化学方程式为CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应为O2+4e-+2H2O=4OH- |
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入
| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )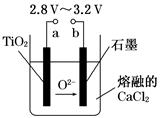
| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
用石墨作电极,电解下列物质的溶液,其实质不是电解水的是( )
| A.NaNO3 | B.NaOH | C.Na2SO4 | D.NaCl |
