题目内容
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+ Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属铜为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
C
解析

练习册系列答案
相关题目
肼(N2H4)——空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+ O2=N2+2H2O。下列关于该电池工作时说法中正确的是
| A.溶液的pH保持不变 |
| B.溶液中的阴离子向正极移动 |
| C.正极的电极反应式:O2+4H++4e—=2H2O |
| D.负极的电极反应式:N2H4+4OH—﹣4e— =4H2O +N2 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
| C.电池反应的化学方程式为CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应为O2+4e-+2H2O=4OH- |
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )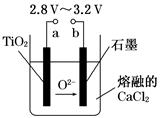
| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
用石墨作电极,电解下列物质的溶液,其实质不是电解水的是( )
| A.NaNO3 | B.NaOH | C.Na2SO4 | D.NaCl |
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O
4H2O
正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
| A.8.9×10-3 mol | B.4.5×10-2 mol | C.1.1×102 mol | D.5.6×10 mol |
锌锰干电池在放电时总反应方程式可以表示为:Zn(s)+2MnO2+2N Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
Zn2++Mn2O3(s)+2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
| A.Zn | B.碳 | C.MnO2和N | D.Zn2+和NH3 |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )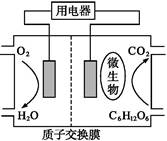
| A.该电池能够在高温下工作 |
B.电池的负极反应为:C6H12O6+6H2O-24e- 6CO2↑+24H+ 6CO2↑+24H+ |
| C.放电过程中,H+从正极区向负极区迁移 |
| D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体L |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min 间的平均反应速率和推测反应16 min 时反应物的浓度,结果应是( )。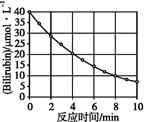
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |