题目内容
11.对于可逆反应:A(g)+2B(g)═2C(g)(正反应为吸热反应),下列各图正确的是( )| A. | 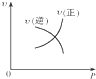 | B. | 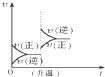 | C. | 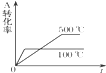 | D. | 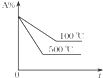 |
分析 A、增大压强,正逆反应速率均会增大;
B、升高温度,正逆反应速率加快,平衡向着吸热方向进行;
C、升高温度,反应速率加快,平衡向着吸热方向进行,据此判断A的转化率的变化;
D、升高温度,反应速率加快,平衡向着吸热方向进行,据此判断A的百分含量的变化.
解答 解:A、正逆反应速率相等的状态是平衡状态,此后增大压强,正逆反应速率均会增大,故A错误;
B、升高温度,正逆反应速率加快,平衡向着吸热方向进行,即向着正方向进行,所以正反应速率大于逆反应速率,故B错误;
C、升高温度,反应速率加快,应该是500℃先建立平衡,故C错误;
D、升高温度,反应速率加快,500℃先建立平衡,升温,平衡向着吸热方向进行,即向着正方向进行,A的百分含量降低,即500℃A的百分含量低,故D正确.
故选D.
点评 本题是一道关于化学反应速率和化学平衡移动综合知识的图象题,关键是注意影响因素和结论的记忆和应用,难度中等.

练习册系列答案
相关题目
1.用已知物质的量浓度的酸测定未知物质的量浓度的碱时,会导致待测碱液的物质的量浓度偏低的操作是( )
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点.
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点.
| A. | ①②④ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
2.下列分子的VSEPR模型与分子的立体构型相同的是( )
| A. | H2O | B. | SO32- | C. | NH3 | D. | CCl4 |
19.下列化合物中只有离子键的是( )
| A. | MgCl2 | B. | Na2O2 | C. | KHSO4 | D. | NH4Cl |
6.下列化学用语正确的是( )
| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: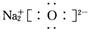 | ||
| C. | CO2的比例模型: | D. | F一的结构示意图: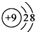 |
3.氯化钠是日常生活中人们常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是( )
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
20.化学式为C8H16O2的有机物A在酸性条件下能水解生成C和D,且C在一定条件下能转化为D,则有机物A的结构可能有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
1.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子核外电子层排布呈周期性变化 | |
| B. | 元素相对原子质量依次递增 | |
| C. | 元素原子半径大小呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
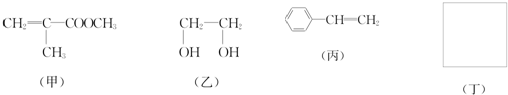
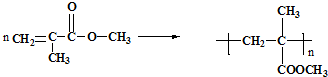
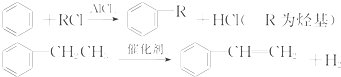 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是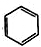 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$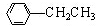 +HCl.
+HCl.